背景介绍
随着生物技术和分子医学的快速发展,mRNA(信使核糖核酸)修饰技术及递送技术也取得了较大进展,并且由于mRNA具有开发简单快速、高特异性、高灵敏度的优势,在新冠疫情期间被制备成mRNA疫苗,一度成为生物医药领域的行业热点。
已知,mRNA是一类携带遗传信息并能直接指导蛋白质生物合成的单链核糖核酸,满足合成各种蛋白质的所有遗传信息的要求。与DNA药物相比,mRNA药物不会插入基因组之中,其可通过正常代谢途径分解,安全性更高。此外,mRNA药物无需进入细胞核就能发挥功能,可以通过体外转录,也可在患者体内合成所需的治疗性蛋白质,设计和起效更加灵活快速,为个性化治疗提供了新方法。
mRNA作为疫苗,可用于癌症免疫治疗、传染病疫苗或蛋白质替代等生物医学和临床医学领域。mRNA作为治疗药物,有望成为多种难治性疾病的有力治疗手段,包括代谢性遗传疾病、癌症、传染性疾病、心脑血管疾病和其他疾病。
据国际市场研究和咨询公司Mordor Intelligence的报告数据,2023年mRNA疫苗和疗法的全球市场规模已经达到了468.3亿美元,且预计未来将以16.8%的复合年增长率迅速扩大,到2028年其全球市场规模有望攀升至1018亿美元。其中根据nova one advisor统计,2023年全球mRNA治疗市场的规模高达121.9亿美元,预测2033年将超过589亿美元,并预计在2024年至2033年间,其复合年增长率将达到17.06%。
目前,mRNA的合成方式主要有化学合成、重组生产、酶法合成等,其中体外转录(酶法)被认为是大规模生产mRNA金标准。mRNA疫苗制备流程主要包括:疫苗靶序列被导入质粒中、质粒DNA模板制备、mRNA体外转录、mRNA纯化、mRNA包封制剂。在mRNA原料药和制剂药物产品生产制备过程中,需要进行测试和过程分析,从而能够更好地进行质量控制和成本控制。然而在mRNA药物从早期研发、到成功上市需要经历多个阶段,每个阶段都存在极其复杂的不确定性,需要对其中多个关键点进行严格的质量控制,从而确保最终产品的安全性和有效性。
mRNA质控的法规药典要求
虽然mRNA疫苗生产工艺流程相对来说比较简单,但mRNA疫苗是一项新兴技术,研发上市与应用时间也较短。法规和监管机构的要求也在随着其工艺的成熟和市场应用情况而不断发展更新,其生产过程中采用的方法大都是复杂的,因此质量控制仍有很多的挑战。
表1.国内外药典法规关于mRNA疫苗的指导原则和质控放行要求
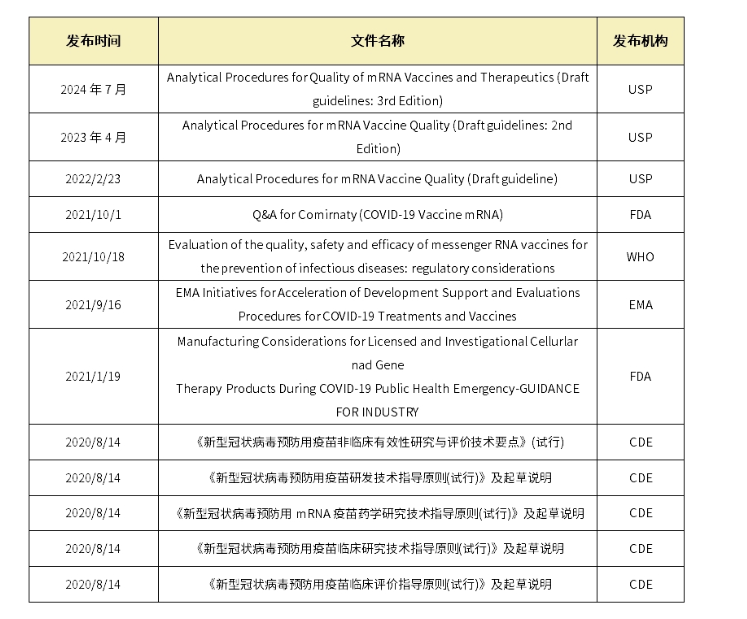
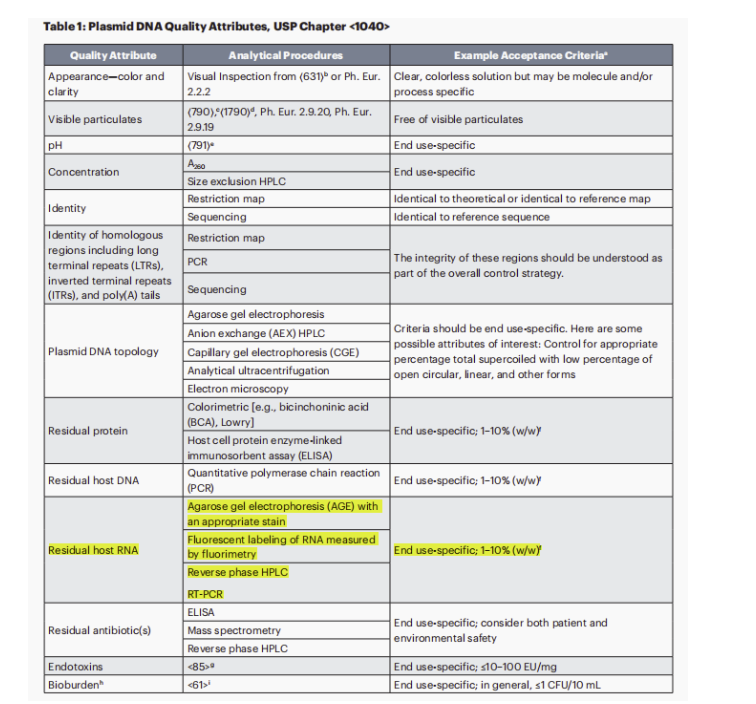
其中,美国药典委员会(USP)于今年7月份又更新和发布了mRNA疫苗和治疗产品质量分析方法-指南草案(第三版)。主要更新了质粒DNA相关的质量属性,要求在:任何一种情况下,用于制造mRNA疫苗的每一批质粒DNA,都必须在释放前进行测试,以确认其身份、纯度和质量。值得关注的更新细节为:对宿主残留RNA检测要求细化了,并对残留限度也做出了要求。
此外,针对线性和自复制mRNA,2023年更新的第二版和今年更新的第三版草案也都提到在mRNA药物原料表征和放行检验中,纯度检测这块新增工艺相关杂质-残留的T7 RNA聚合酶含量检测,这是首次对mRNA工艺过程中引入的单酶杂质检测提出质控要求。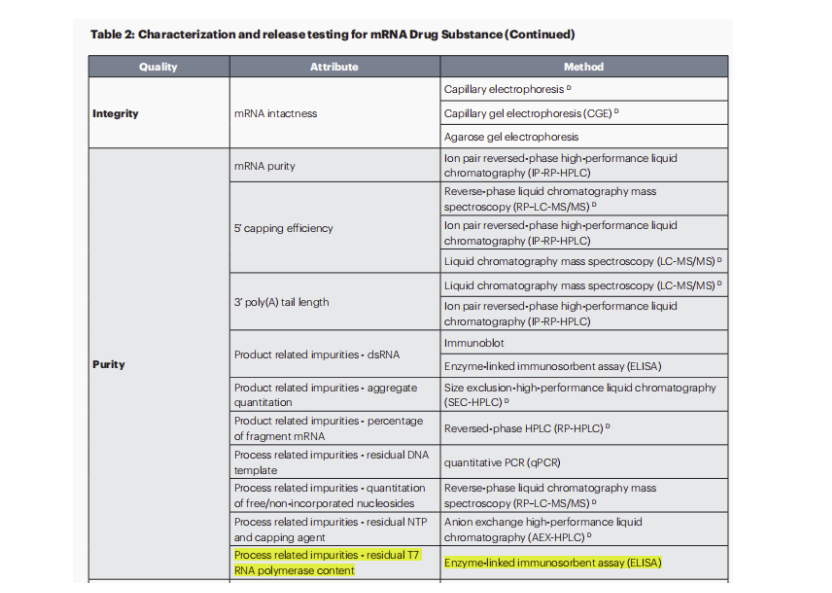
翌圣生物mRNA疫苗质量控制整体解决方案
针对mRNA疫苗进行的质量控制,不仅关系到疫苗的安全性(如确保疫苗中不含有内毒素、微生物和其他潜在的有害物质),还影响疫苗的有效性,即刺激免疫反应的能力,这就需要质量控制确保疫苗中mRNA的含量、纯度和生物学活性达到预定标准。更重要的是,鉴于COVID-19疫情的影响,建立能够快速开发和高度复杂的mRNA疫苗质量控制流程,还有助于应对全球公共卫生危机。因此,中美欧等国内外的监管机构对于mRNA疫苗的质量安全控制检测都严格管控。
针对上述情况,翌圣生物自主研发了一系列mRNA疫苗研发和生产等流程中所需的质量安全控制检测试剂盒,其中包括早期的质粒DNA模板检测所需的宿主细胞残留DNA、残留RNA、残留蛋白等检测试剂盒,以及mRNA原液生产工艺过程中所需的各种关键酶残留检测试剂盒等。

图1.mRNA药物研发及生产流程中翌圣质控产品推荐
选择翌圣质控产品的原因
宿主细胞残留DNA(HCD)检测
去除宿主细胞杂质是mRNA疫苗、抗体药物等在内的生物制药产品生产中的关键步骤,其中宿主细胞残留DNA由于可能存在的免疫原性、感染性以及致瘤性等安全问题成为关键质控指标。在此情况下,建立合适的检测方法监测生产工艺,控制宿主细胞残留核酸限度,以确保产品的安全性和质量已经成为监管机构和行业内关注的重点。
§
《中国药典》2020年版三部规定,以细胞基质生产的生物制剂外源宿主细胞DNA残留量不能超过100pg/剂,以细菌或真菌基质(酵母、大肠杆菌等)表达的生物制品中DNA残留量不超过10ng/剂。
§
《欧洲药典》(EP10.0)通则规定的生物制品残留DNA限度大多为不超过10ng/剂。
§
美国食品药品监督管理局(FDA)发布的指导原则中指出生物制品宿主细胞DNA残留限度不得超过100pg/剂,对于大剂量的生物制品(如单克隆抗体),根据其残留DNA来源及给药途径,DNA残留量可放宽至10ng/剂。
§
此外,《中华人民共和国药典》2020年版第三部规定,外源性DNA残留检测采用DNA探针杂交法、荧光染色法和定量PCR法。目前市场上对宿主细胞残留DNA检测,主要采用荧光探针qPCR方法,qPCR法具有极高的灵敏度、序列特异性和准确性,可为生物制药工业在工艺研究和成品质量控制方面提供可靠的检测手段,现也已成为各生物制品厂家首选检测方法。
翌圣生物自主研发的E.coli宿主细胞残留DNA的qPCR法检测试剂盒,可快速高效检测生物药中宿主DNA残留量。还研发了与之配套使用的宿主细胞残留DNA样本前处理试剂盒,以及配套的自动化核酸提取仪器。
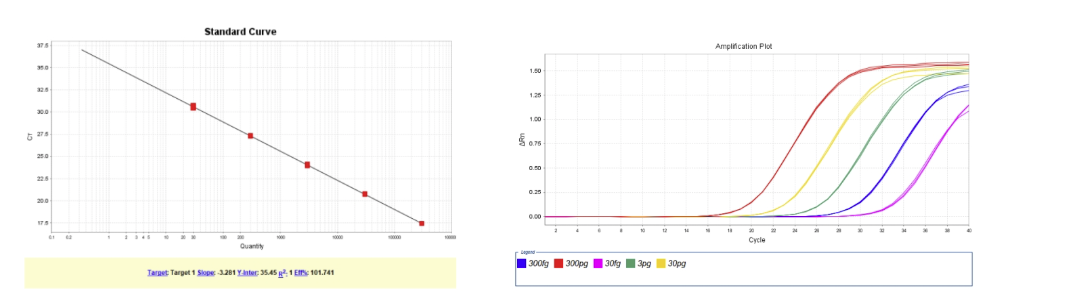
图2. E.coli DNA (2G)标曲范围30fg/μL~300pg/μL,R2=1,扩增效率为101.74%,各浓度检测值CV<15%
宿主细胞残留蛋白(HCP)检测
生物制品中HCP残留含量通常被认为是产品的关键质量属性(CQA),是工艺稳健性监测的重要评价指标,也是产品的重要质控指标。各国法规都有涉及HCP的论述,要求必须对生物药品进行分析和纯化,以将宿主细胞蛋白HCP降低到可接受的水平。
《中国药典》三部(2020版)规定:针对CHO细胞,HCP残留需要<0.05%(相当于小于500ppm);针对E.coli,HCP残留需要<0.01%。
美国药典USP<1132>章节规定:用一种灵敏度较高的方法检测药品中的HCP,其含量应该低于检测限(通常小于100ppm,即1mg总蛋白中HCP含量应小于100ng,也即<0.01%)。
酶联免疫吸附法(ELISA)是目前HCP检测最常用的方法,在2020版《中国药典》通则3412/3413/3414中提到的宿主蛋白残留检测方法均为ELISA法。
翌圣生物科技(上海)股份有限公司自主研发了包括E.coil宿主细胞在内的多款HCP蛋白残留量检测试剂盒。试剂盒均采用双抗夹心酶联免疫检测(ELISA)的实验原理,以及生物素-链霉亲和素放大系统,能够高灵敏的检测样本中HCP残留量。试剂盒可以用于生物制品纯化工艺过程的优化、中间工艺过程的杂质控制以及终产品的放行检测。
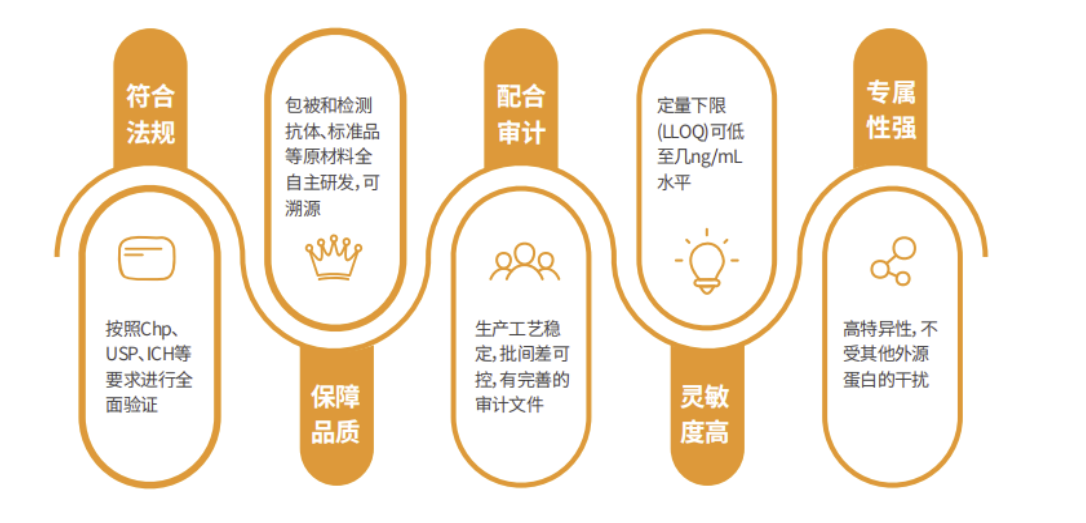
图3. 翌圣HCP ELISA试剂盒产品特点
mRNA合成所需工具酶残留检测
已知,mRNA疫苗规模化生产过程中涉及的工具酶主要包括T7 RNA聚合酶、Inorganic Pyrophosphatase无机焦磷酸酶、Vaccinia Capping Enzyme牛痘病毒加帽酶、RNA Inhibitor RNA酶抑制剂等。
在使用这些工具酶进行mRNA疫苗研发和生产的同时,会引入这些工艺相关杂质即工具酶的残留,故需使用酶残留检测ELISA试剂盒进行mRNA合成相关酶含量监测。在残留量低于一定范围时,纯化的mRNA工艺过程制备液才可以进入下一生产阶段。
为此,翌圣生物又开发了针对mRNA合成所需酶残留检测的ELISA试剂盒,该试剂盒应用双抗夹心酶联免疫检测(ELISA)的实验原理进行酶残留量检测,将mRNA合成所需酶标准品和待测样本加入预包被抗工具酶抗体的酶标板,然后加入稀释后的生物素标记的工具酶检测抗体,最后加入Streptavidin-HRP (SA-HRP),形成抗体+抗原+抗体-Biotin+SA-HRP复合物,洗板后加入TMB显色液显色。TMB在HRP酶的催化下由无色转化成蓝色并在终止液的作用下最终转化成黄色。黄色的深浅与样本中被检测到的工具酶的量呈正相关。
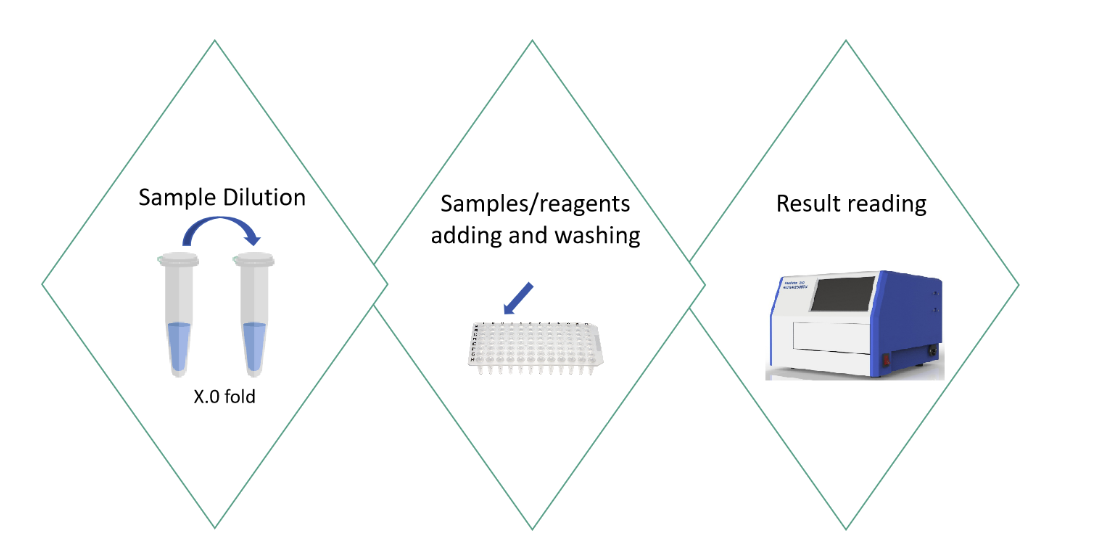
图4. 翌圣生物mRNA合成关键酶残留检测的ELISA实验过程
产品信息
|
类别 |
产品 |
货号 |
品名 |
规格 |
|
宿主细胞 残留核酸检测 |
样本前处理 试剂盒 |
18461ES |
MolPure® Magnetic Residual DNA Sample Preparation Kit 磁珠法残留DNA样本前处理试剂盒(瓶装) |
25T/100T |
|
18467ES |
MolPure® Mag48 Sample Preparation Kit FN 磁珠法48孔样本前处理试剂盒FN(预封装) |
3×16T/ 6×16T |
||
|
核酸提取仪器 |
80511ES |
48通道自动化核酸提取仪 |
48通量 |
|
|
残留DNA 试剂盒 |
41308ES |
E.coli Host Cell DNA Residue Detection Kit (2G) E.coli宿主细胞DNA残留检测试剂盒(2G) |
50T/100T |
|
|
41323ES |
Plasmid DNA Residue Detection Kit 质粒DNA残留检测试剂盒 |
50T/100T |
||
|
片段分析试剂盒 |
41337ES |
E.coli Host Cell Residue DNA Size Analysis Kit E.coli 宿主细胞残留DNA片段分析试剂盒 |
4×50T/ 4×100T |
|
|
残留RNA 试剂盒 |
41318ES |
E.coli Host Cell RNA Residue Detection Kit E.coli宿主细胞RNA残留检测试剂盒 |
50T/100T |
|
|
宿主细胞 残留蛋白检测 |
HCP试剂盒 |
36712ES |
E.coli HCP ELISA kit E.coli HCP ELISA检测试剂盒 |
48T/96T |
|
36721ES |
E.coli HCP ELISA Kit (Plasmid) E.coli HCP ELISA检测试剂盒(质粒) |
48T/96T |
||
|
酶残留检测 |
工具酶残留ELISA试剂盒 |
36705ES |
T7 RNA Polymerase ELISA Kit T7 RNA聚合酶ELISA检测试剂盒 |
48T/96T |
|
36706ES |
Inorganic Pyrophosphatase ELISA Kit 无机焦磷酸酶ELISA检测试剂盒 |
48T/96T |
||
|
36707ES |
Murine RNase Inhibitor ELISA Kit 鼠源RNase抑制剂ELISA检测试剂盒 |
48T/96T |
||
|
36709ES |
Vaccinia Capping Enzyme ELISA Kit 牛痘病毒加帽酶检测试剂盒 |
48T/96T |
||
|
36717ES |
Double-stranded RNA (dsRNA) ELISA Kit 双链 RNA (dsRNA) ELISA 检测试剂盒 |
48T/96T |
||
|
41309ES |
RNase Viability Assay Kit (Fluorescent Labeling) RNase活性检测试剂盒(荧光标记法) |
1×96T/ 5×96T |
||
|
41322ES |
DNase Viability Assay Kit (Fluorescent Labeling) DNase 活性检测试剂盒(荧光标记法) |
48T/ 192T |
