蛋白纯度≥99%,65℃加热10 min即可快速失活,对样品中RNA无影响。
在诊断或研究由病原感染引起的疾病时,当前的检测方法大多针对病原体的基因组进行诊断。然而,仅依靠检测病原体的基因组核酸只能确认病毒的存在,不足以反映持续感染或整合入宿主基因组的风险。例如,人乳头瘤病毒(HPV)DNA的检出可能只是一次性感染,不代表持续病变或癌变风险。相反,检测HPV E6/E7 mRNA水平能提供更精确信息,评估HPV在宿主体内的基因组整合、转录活性及持续感染和致癌可能性。这种方法更关注“病变”而非仅仅是“感染”,有助于识别可能进展为浸润癌的癌前病变,避免对一次性HPV感染及其良性病变的过度探查和不必要治疗。
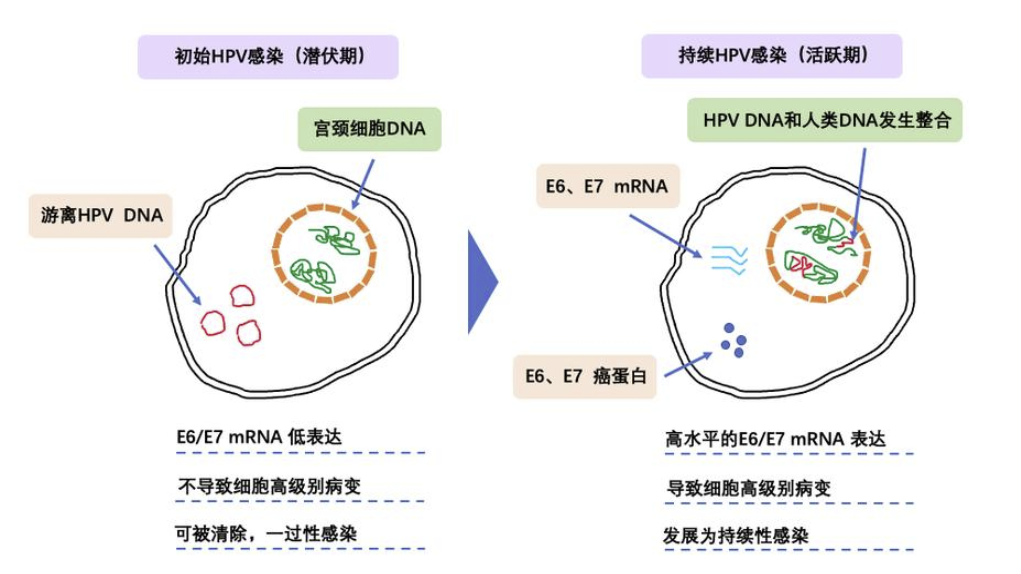
图1:HPV病毒感染宫颈细胞示意图
为确保基因mRNA表达量分析的准确性,必须排除样本中基因组DNA(gDNA)的干扰,因为其存在可能导致mRNA定量结果的误差,有效去除mRNA样本中的gDNA一直是一个技术难题。目前,DNase I是主流用于去除gDNA的酶,但DNase I的灭活需要在体系中额外加入EDTA,容易导致后续扩增反应受抑制。
翌圣Thermolabile dsDNase
针对以上问题,翌圣生物推出了一种热敏双链DNA特异性核酸酶——Thermolabile dsDNase。该酶能够选择性地降解双链DNA,而对单链核酸分子几乎没有影响。通过裂解双链DNA中的磷酸二酯键,生成带有5'-磷酸和3'-羟基末端的寡核苷酸片段。更重要的是,该产品具有热敏感性,在65°C条件下可以迅速失活。相比传统的DNase I,Thermolabile dsDNase更适合快速去除基因组DNA,并且与RT-PCR反应缓冲液兼容,因此可以直接应用于RT-PCR/qPCR等过程中,以清除gDNA污染,从而提高反转录效率。
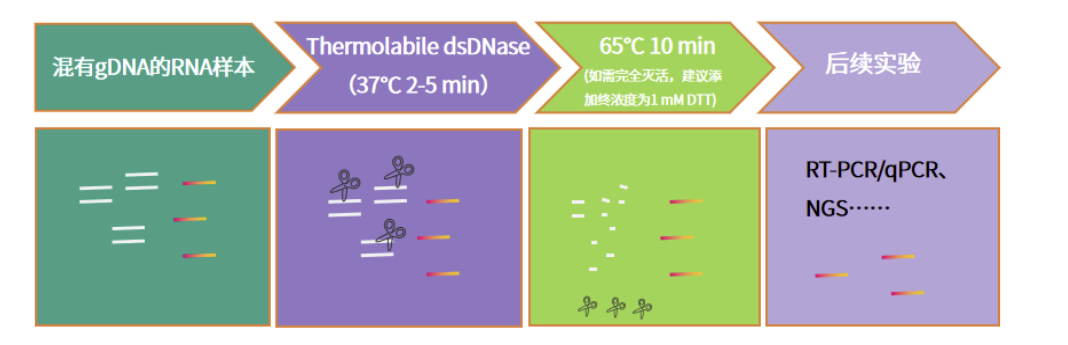
图2. Thermolabile dsDNase去除gDNA示意图
产品特点
· 高效:只需37℃ 5 min即可消化1 μg基因组DNA;
· 纯度高:蛋白纯度≥99%;
· 无RNase酶残留:对样品中RNA无影响;
· 热敏感:65℃加热10 min即可快速失活,无需纯化,gDNA去除与逆转录反应可在同管内完成;
· 应用广泛:RNA提取或反转录实验前去除gDNA、分子诊断试剂原料中背景菌gDNA污染去除。
性能展示
1. 纯度高:蛋白纯度≥99%
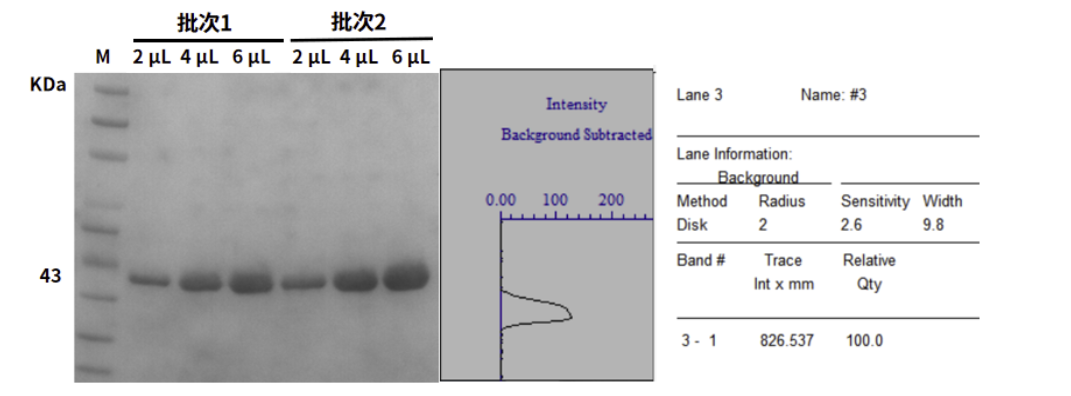
图3:SDS-PAGE法检测14544ES蛋白纯度结果
1. 无RNase酶残留:对样品中RNA无影响
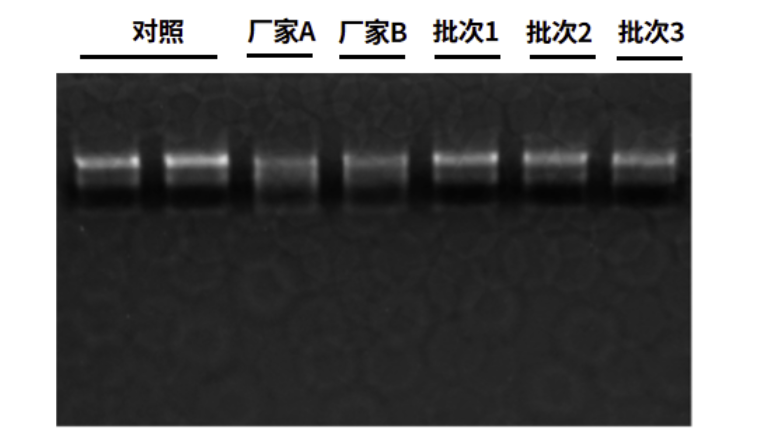
图4:20 μL反应体系中加入20 U来自进口厂家A、进口厂家B和翌圣3批次Thermolabile dsDNase,同时分别加入0.5 μg 293T RNA,37℃孵育4小时。琼脂糖凝胶电泳结果显示,翌圣3批次Thermolabile dsDNase组RNA谱带与阴性对照一致,进口厂家A和进口厂家B组RNA条带有轻微降解,说明翌圣3批次Thermolabile dsDNase中无RNase残留,对样本中RNA无影响。
1. 热敏感:65℃加热10 min即可快速失活
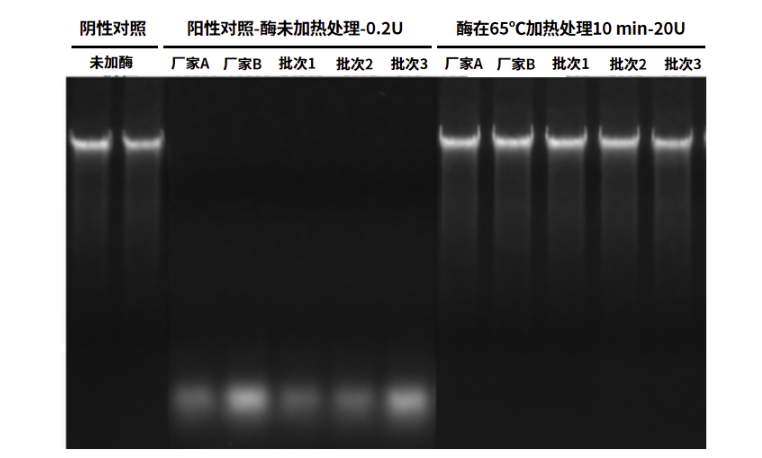
图5:Thermolabile dsDNase热敏感性验证结果图。阴性对照组:未加dsDNase酶;阳性对照组:反应体系中加入0.2 U来自进口厂家A、进口厂家B和翌圣3批次Thermolabile dsDNase;热处理组:反应体系中加入20 U来自进口厂家A、进口厂家B和翌圣3批次经过65℃加热10 min处理的Thermolabile dsDNase酶。然后,分别在体系中加入1 μg小牛胸腺DNA,37℃孵育5 min。琼脂糖凝胶电泳结果显示,0.2 U Thermolabile dsDNase可消化1 μg小牛胸腺DNA,Thermolabile dsDNase经过65℃孵育10 min可完全失活。
YEASEN相关产品
|
产品定位 |
产品名称 |
产品货号 |
|
gDNA去除 |
Thermolabile dsDNase |
14544ES |
|
Recombinant DNase I (RNase-free) |
10325ES |
|
|
UCF.ME® Deoxyribonuclease I (DNase I) GMP-grade |
10611ES |
|
|
高性能PCR单酶系列 |
10726ES |
|
|
11300ES |
||
|
10303ES |
||
|
10603ES |
||
|
10125ES |
参考文献
1. Ndiaye C, Mena M, Alemany L, et al. HPV DNA, E6/E7 mRNA, and p16INK4a detection in head and neck cancers: a systematic review and meta-analysis[J]. The Lancet Oncology, 2014, 15(12): 1319-1331.
2. Broccolo F, Fusetti L, Rosini S, et al. Comparison of oncogenic HPV type‐specific viral DNA load and E6/E7 mRNA detection in cervical samples: results from a multicenter study[J]. Journal of medical virology, 2013, 85(3): 472-482.
