7月13日,由石河子大学动物科技学院皮文辉研究员团队培育的两只羊宝宝“强强”“壮壮”迎来满月。皮教授团队使用NEPA21高效基因转染系统(NEPA GENE),通过电穿孔技术将Cas9 RNPs成分递送入绵羊体外受精胚胎,成功敲除了肌肉生长抑制素(MSTN)基因,从而获得了具有更好肌肉品质和更高产肉量的基因编辑绵羊。

此学术论文已在国际知名科学期刊《International Journal of Molecular Sciences》上发表,题为“Electroporation Delivery of Cas9 sgRNA Ribonucleoprotein Mediated Genome Editing in Sheep IVF Zygotes”。

目前,显微注射和电穿孔是两种常用于将CRISPR/Cas9传递到哺乳动物受精卵中的技术。虽然显微注射技术精确且可重复,但它操作复杂,每次注射的目标有限,成本昂贵并且需要广泛的技术培训,不适合大规模应用。相比之下,电穿孔技术作为一种更高效、可扩展的基因组编辑方法正逐步流行,它简化了操作过程,提高了胚胎存活率、转染率和发育潜力。多种动物模型,包括大鼠、小鼠、牛和猪,已经成功地通过电穿孔CRISPR/Cas9系统进行了基因修饰。
在本研究中,作者设计了五个实验,以羊的ACTG1和MSTN基因为对象,通过使用NEPA21高效基因电转染系统(NEPA GENE)探索了不同电转染参数对基因编辑效率的影响。在实验1中,研究者设置了三组不同的电穿孔参数(40V,3.5ms;41V,3.5ms;42V,3ms)来研究它们对绵羊受精卵分裂和囊胚形成率的影响(见表1和图1)。他们使用sf-Cas9 RNPs靶向绵羊的ACTG1基因位点,并评估了在三种不同电穿孔参数下的基因编辑效率。电穿孔在受精后6小时进行,结果显示,最佳的电穿孔电压和脉冲长度组合为40~42V和3.0~3.5ms。此外,更强的电场可能需要配合更短的脉冲持续时间,以实现高效基因编辑而不损伤受精卵。
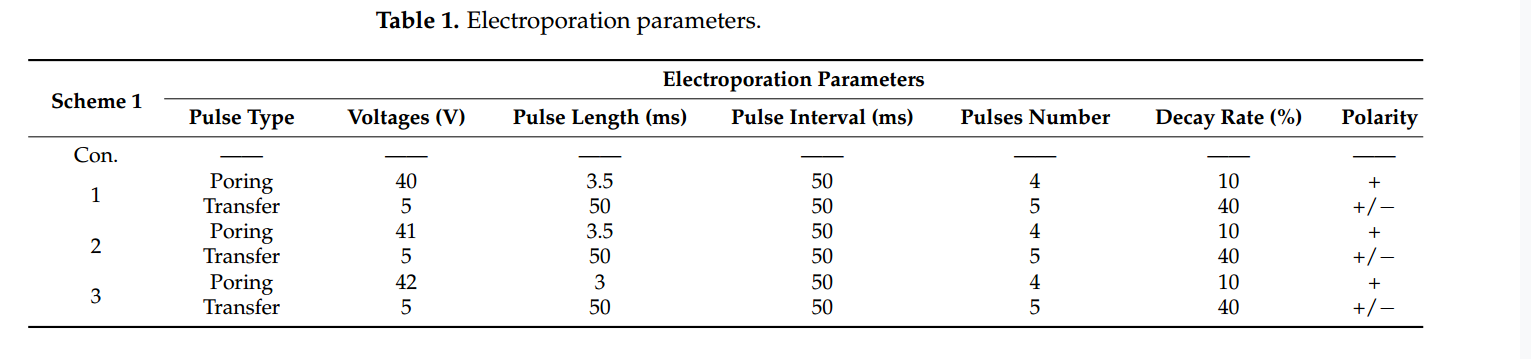
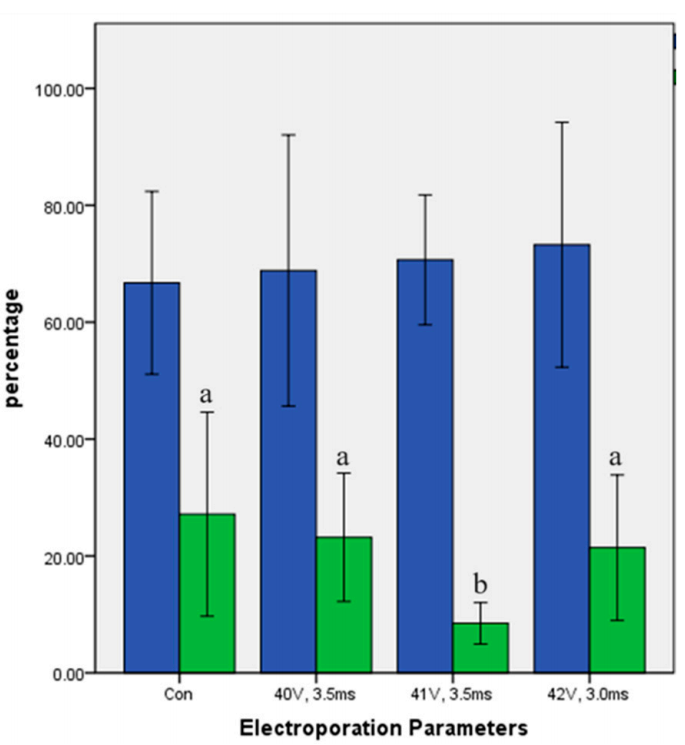
图1.针对绵羊ACTG1基因的靶向后,分裂和囊胚率(均值±标准差)。不同字母表示显著差异(p<0.05)。蓝色条表示IVF后的受精卵分裂率。绿色条表示囊胚形成率。
在实验2中,作者探究了三种不同的Cas9 RNPs组分对绵羊电穿孔受精卵突变的影响。作者使用了40V、3.5ms的电穿孔参数,直接电转染与sgRNA预孵育的sf-Cas9 RNPs,发现这可以提高基因编辑效率。结果表明,Cas9 RNPs中sgRNA的高饱和度能显著提高基因编辑的成功率。研究者比较了三组不同成分RNP转染后囊胚编辑效率:
1、单独使用自组装Cas9 RNPs的组别,突变效率为30.28%±9.14%(见图2)。
2、使用合成靶向sgRNAs预孵育的sf-Cas9 RNPs组别(sf-Cas9 RNPs+sgRNA),突变效率显著更高,达到87.78% ±10.72%(见图2)。
3、完全体外组装的Cas9 RNPs组别,效率为82.14%±15.57%(见图2)。
实验结果表明,在进行电穿孔之前,将Cas9蛋白与sgRNA预先孵育,可以显著提高绵羊受精卵基因编辑的突变效率。
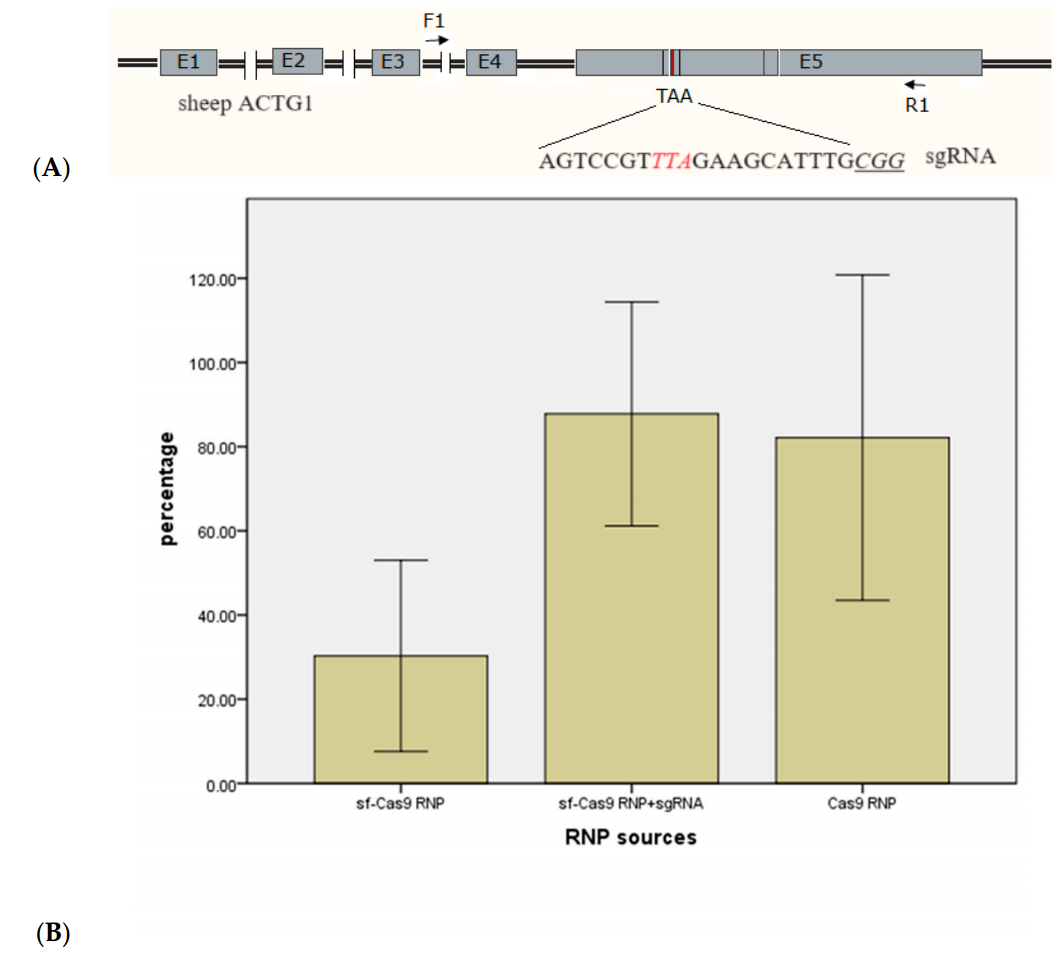
图2.三种Cas9 RNPs对绵羊囊胚编辑突变率的影响(ACTG1位点)
在实验3中,作者通过电穿孔传递Cas9 RNPs至绵羊MSTN基因位点,提高了突变效率。使用完全体外组装的Cas9 RNPs,并设置了两组不同的电穿孔参数:(40V,3.5ms)和(42V,3ms),将Cas9 RNPs转染到绵羊受精卵中。结果显示,电穿孔显著提高了绵羊囊胚中基因组靶标的突变率,且这种增加是显著的(p<0.01,见图3)。在这两组电穿孔参数下,有非常高比例的囊胚表现出突变,突变率分别为84.55%±1.19%和82.83%±0.87%(见图3)。
这些发现表明,所测试的两组电穿孔参数都适合于IVF绵羊受精卵的基因编辑,能够有效地提高基因编辑的效率。
图3.绵羊MSTN基因靶向后的突变率(均值±标准差)
在实验4中,作者探索了Cas9 RNPs和单链寡核苷酸(ssODNs)的结合对绵羊胚胎基因编辑的影响。作者使用了40V、3.5ms的电穿孔参数来传递以下混合物:Cas9蛋白(200ng/µL)、针对MSTN基因位点的sgRNA(300ng/µL)、含有由同源序列flanked的EcoR I和EcoR V位点的ssODNs(420ng/µL),电穿孔后,研究者提取了模板DNA用于聚合酶链式反应(PCR)扩增。然后,他们使用基于PCR产物的测序结果来分析绵羊囊胚的基因分型。实验结果显示,小的DNA片段可以通过与Cas9 RNPs的电穿孔有效地插入到绵羊受精卵的目标区域。ssODNs的引入导致囊胚中26%的同源重组率,其中2%的囊胚为纯合子。此外,研究还发现增加ssODNs的长度可以进一步提高同源重组的效率。
在实验5中,研究者将经过MSTN基因编辑的囊胚转移到受体母羊中。移植成功并生产了两只雄性羔羊(见图4)。其中,羔羊1具有斑点毛色,而羔羊2则是纯白色。对这两只羔羊的MSTN基因进行了分析,结果显示它们的突变率异常高,分别为94.5%和94.9%。这表明通过电穿孔技术处理IVF绵羊受精卵进行基因编辑是成功的。该结果进一步证实了CRISPR/Cas9系统在诱导羔羊中遗传修饰方面的高效性。MSTN基因是肌肉生长的一个关键调节因子,因此该基因的成功编辑可能对提高绵羊的肌肉质量和改善其生产性状具有重要意义。此外,这项研究表明电转染技术有潜力成为绵羊养殖业中基因组编辑和育种的有效工具,为未来在畜牧业中应用基因编辑技术提供了有力的证据。

图4.出生20天后的基因编辑羔羊
NEPA21高效基因转染系统采用全新设计的电转程序,配合专利的电压衰减设计,在获得高转染效率的同时,提高细胞存活率。操作简单,电转参数可见可调,适用性强。特别适用于难转染的原代免疫细胞、干细胞、神经细胞、活体动物、受精卵及宫内胚胎等的转染,多篇文献支持!咨询可识别下方二维码。

参考文献:
1. Pi, W.; Feng, G.; Liu, M.; Nie, C.; Chen, C.; Wang, J.; Wang, L.; Wan, P.; Liu, C.; Liu, Y.; et al. Electroporation Delivery of Cas9 sgRNA Ribonucleoprotein-Mediated Genome Editing in Sheep IVF Zygotes. Int. J. Mol. Sci. 2024, 25, 9145.
2. Kalds, P.; Zhou, S.; Cai, B.; Liu, J.; Wang, Y.; Petersen, B.; Sonstegard, T.; Wang, X.; Chen, Y. Sheep and Goat Genome Engineering:From Random Transgenesis to the CRISPR Era. Front. Genet. 2019, 10, 750.
3. Wang, J.Y.; Doudna, J.A. CRISPR technology: A decade of genome editing is only the beginning. Science 2023, 379.
4. Wang, X.; Niu, Y.; Zhou, J.; Yu, H.; Kou, Q.; Lei, A.; Zhao, X.; Yan, H.; Cai, B.; Shen, Q.; et al. Multiplex gene editing via
CRISPR/Cas9 exhibits desirable muscle hypertrophy without detectable off-target effects in sheep. Sci. Rep. 2016, 6, 32271.
5. Crispo, M.; Mulet, A.P.; Tesson, L.; Barrera, N.; Cuadro, F.; dos Santos-Neto, P.C.; Nguyen, T.H.; Crénéguy, A.; Brusselle, L.Anegón, I.; et al. Efficient Generation of Myostatin Knock-Out Sheep Using CRISPR/Cas9 Technology and Microinjection into Zygotes. PLoS ONE 2015, 10.
