由中国药理学会药物毒理专业委员会主办,上海市药理学会毒理专业委员会和国家上海新药安全评价研究中心共同承办的免疫原性评价培训班,于6月6日在北京圆满结束。本次培训班吸引了近190余位来自科研机构和医药企业的同行参与,会议内容包括免疫原性评价介绍、免疫原性分析方法学验证及免疫原性分析、免疫原性对于药代、毒代、药效及安全性影响等方面,学术氛围浓厚,培训内容实用,得到了参会者一致好评。

(图片来自会议现场)
以下是小编为您带来的部分精彩内容:
主题:2016版FDA免疫原性指导原则解读
演讲嘉宾:赵小平(国家上海新药安全评价研究中心)
要点:
免疫原性分析作为免疫原性评价的重要手段,一直以来缺乏明确的可操作的指导原则。2016版FDA免疫原性指导原则(试行)的发布给免疫原性分析指明了道路。该报告将2016版FDA免疫原性指导原则(试行)进行解读,并就其与2009版免疫原性指导原则的变化进行比较,为我国免疫原性指导原则的起草提供建议。
免疫原性是指机体对治疗性蛋白产生的免疫反应或导致免疫相关的临床副作用。指导原则中描述了免疫原性分析中方法开发,建立,验证及样品分析的各个阶段,并为各验证项提出了具体的建议和规范。免疫原性试验设计为多步检测法,包括筛选、确证、滴度和中和抗体检测,需要考虑的影响因素包括临界值、灵敏度、特异性和选择性、精密度、重复性、耐用性、稳定性等。

(图片来自会议现场)
实验过程中最重要的试剂是阳性对照抗体,决定试验的灵敏度。阳性对照抗体可以通过免疫动物拿到免疫亲和纯化的多抗或单抗。

(图片来自会议现场)
与2009版相比,2016版指导原则明确规定采用阳性对照抗体作为随行指控,随性质控仅需包括阴性对照、低浓度和高浓度的阳性对照。2016版指导原则还对精密度和灵敏度做了要求和规定标准。

(图片来自会议现场)
主题:生物类似药的免疫原性评价
演讲嘉宾:赵小平(国家上海新药安全评价研究中心)
要点:
生物类似药指的是在质量、安全性和有效性方面与已获注册的参照药具有相似性的生物制品。生物类似药在评价中与原研参照药采用头对头比对原则,应与参照药相似。该报告对生物类似药的免疫原性评价试验设计及分析方法进行阐述,并对生物类似药的免疫原性评价提出建议。生物类似药评价主要参考FDA、EMA和CFDA的指导原则,遵循比对原则、逐步递进原则、一致性原则和相似性评价原则。
非临床阶段的免疫原性评价技术和方法尽可能与参照药一致,包括筛选、确证、定量和定性,必要时进行交叉反应测定。

(图片来自会议现场)
临床阶段的免疫原性实验在药代、药效和/或有效性比对试验中进行,选择测定免疫应答差异最敏感的适应症人群进行比对试验。

(图片来自会议现场)
免疫原性评价的方法选择上,类似药尽可能采用与参照药一致的分析模式,分析方法可选用ELISA或ECL。类似药与参照药可选择一套方法或两套方法。一套方法通常以生物类似药建立方法,以生物类似药和/或参照药制备阳性对照抗体,同时给予生物类似药的样品和参照药的样品检测,以生物类似药和参照药对阳性对照抗体交叉验证。目前大都推荐使用一套方法。
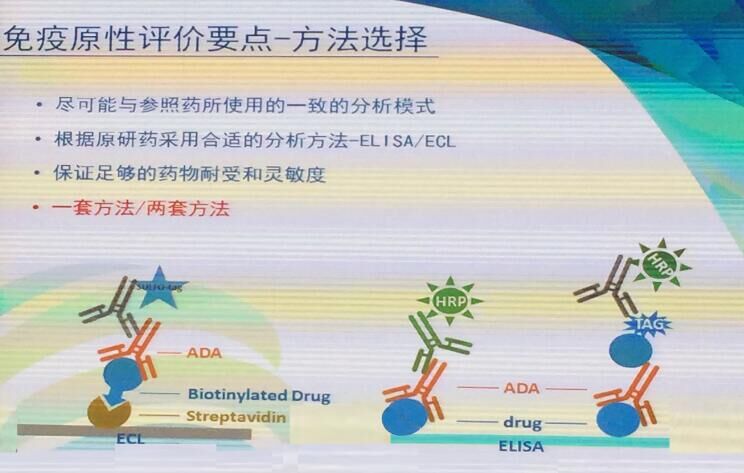
(图片来自会议现场)
主题:免疫原性分析方法的建立及验证
演讲嘉宾:任欣怡(国家上海新药安全评价研究中心)
要点:
免疫原性的评价方式主要采用抗药抗体分析的方法进行。由于阳性对照抗体无法准确反映样本中抗药抗体的真实情况,免疫原性分析只能采用半定量的方式进行。该报告中对免疫原性分析方法建立过程中的各部分进行说明,并对验证过程中各验证参数的验证方法进行阐述和举例,为后续我国免疫原性分析方法相关的指导原则建立提供建议。免疫原性分析技术包括ELISA、ECL、SPR、RIA,可灵活采取一种或几种组合。
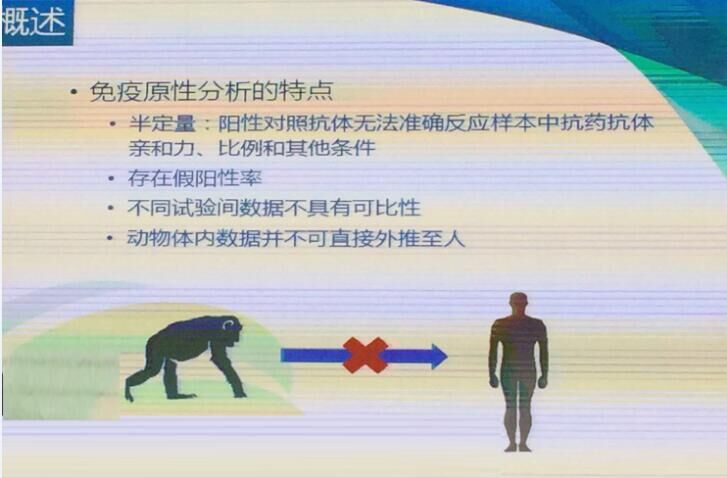
(图片来自会议现场)
免疫原性分析方法建立过程中需要采用阳性对照抗体进行条件优化,在验证过程中需要借助阳性对照抗体对方法的参数进行验证和说明。阳性对照抗体通常采用多抗或单抗,临床前对种属没有特殊要求,推荐兔源和羊源,临床上推荐食蟹猴或其他非灵长类。
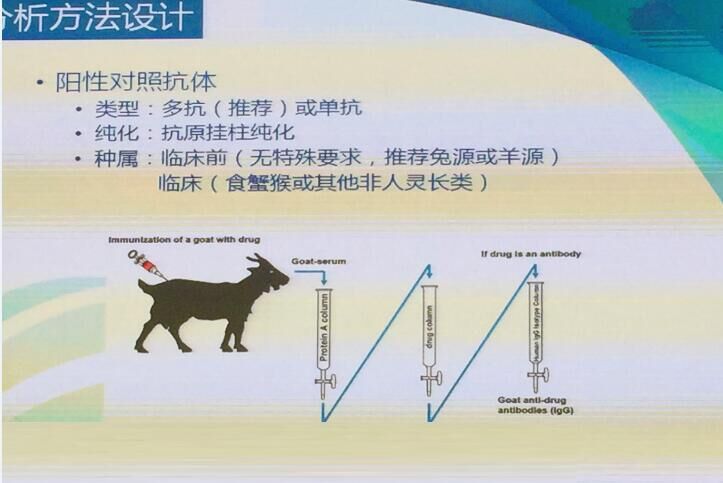
(图片来自会议现场)
生物类似药的免疫原性评价推荐使用一种检测方法:即针对供试品建立检测方法,比较供试品与对照品耐药性在同一阳性对照抗体浓度水平下的曲线,通过曲线重合程度进行交叉验证。
主题:中和抗体分析方法的验证及建立
演讲嘉宾:朱晰(国家上海新药安全评价研究中心)
要点:
抗药抗体的中和活性检测,是ADA表征的重要部分。其产生往往与生物技术药物体内药效及药代行为的改变具有紧密的联系。中和抗体直接影响药物和靶点的相互作用。由于与结合抗体方法的差异和模式的多样性,中和抗体分析方法的建立及验证往往具有较大的难度。该报告针对中和抗体方法开发和验证中的难点和一些关键点进行探讨,特别是分析方法的模式选择(cell-based or non-cell based)、不同模式的适用性、方法开发中的关键点、阳性抗体选择、验证中的关键参数和意义等问题。

(图片来自会议现场)
分析方法建立的关键是充分理解药物的生物学活性以及关键的生物学通路。分析模式包括cell-based和non-cell based,监管机构更推荐使用cell-based的方式,但一些情况下也会选择non-cell based,比如相关细胞系较难获得、难培养,基质干扰无法解决,cell assay信号范围极小,需要更高的灵敏度等原因。

(图片来自会议现场)
中和抗体分析的阳性对照抗体需要有明显的中和活性,单抗或多抗都可以,推荐使用anti-idiotypic antibody作为阳性对照抗体。
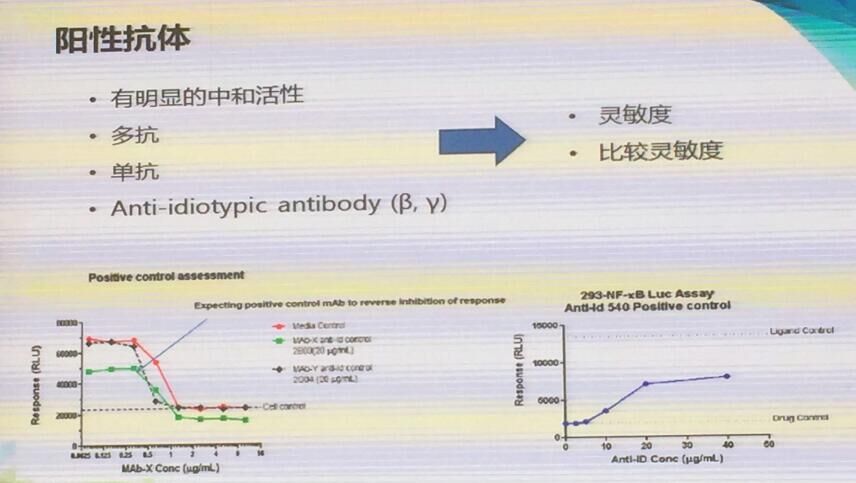
(图片来自会议现场)
中和抗体分析的目标是建立可能由于药物被中和而导致的临床观测指标与中和抗体测定结果之间的相关性。Assay format选择的关键是对MOA和生物学通路的理解。中和抗体获得的数据需要积累临床观测指标来验证。
如需详细内容,请发邮件至 mkt@acrobiosystems.com 或在后台留言,我们会尽快与您联系。
中文官网:http://www.acrobiosystems.cn/
