重组腺相关病毒(RecombinantAdeno-associated Virus, rAAV)是一种可以高效递送外源基因在体内稳定表达的工具病毒载体,具有免疫原性低、转导效率高、无自主复制能力等多种特点,且拥有上百种靶向性各异的血清型,可实现特异组织/细胞基因递送。基于多种优点,rAAV被广泛应用于临床前基因功能研究和人类重大疾病的基因治疗,如视网膜疾病、血友病、神经系统疾病及心血管疾病等。数款rAAV基因治疗药物获批临床应用。
目前rAAV在基础研究和基因治疗领域被大量应用,然而对于rAAV载体在细胞水平上与宿主之间的相互作用理解仍不完全,提高这方面的认识将有助于更精准地以细胞/组织特异性的方式调控基因的表达,提高rAAV转导效率,增加临床试验中rAAV基因治疗的成功。
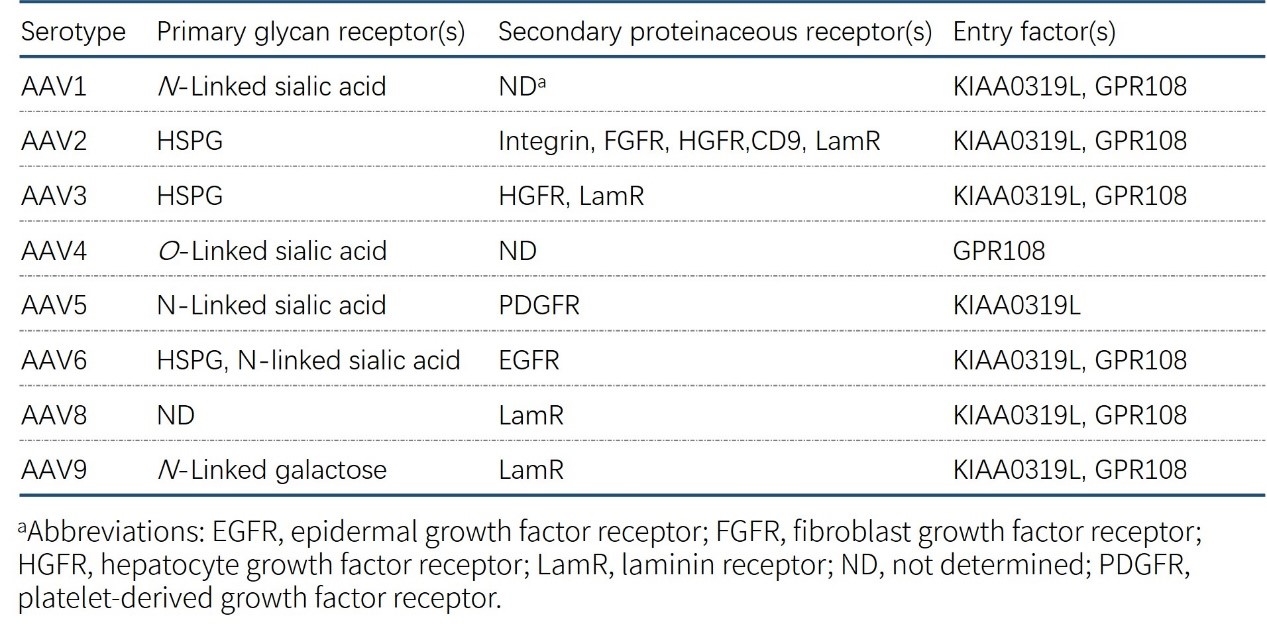
rAAV感染机制的第一步是先要进入细胞,目前微小病毒进入细胞的方式是从衣壳结合到细胞表面的聚糖或糖复合物开始的,这促进了衣壳与细胞表面的共受体相互作用,实现内化(图1A)。rAAV不同血清型衣壳的特定结构位点决定了各自聚糖受体和共受体的特异性(表1)。如AAV2,其结合以硫酸乙酰肝素蛋白多糖(heparan sulfate proteo-glycan,HSPG)为主要受体,并利用整联蛋白和生长因子受体作为共受体进入细胞。同时,全基因组筛查发现,跨膜蛋白KIAA0319L是rAAV转导细胞所必需的宿主因子,可作为几种常见的rAAV血清型的受体,被命名为通用AAV受体(AAVR),当衣壳与细胞表面的聚糖结合稳定,rAAV通过KIAA0319L依赖或非依赖的方式进行内化。
表一 AAV血清型特异性受体,共受体和进入因子
rAAV与细胞表面特异性受体结合,激活胞内信号通路,进而触发受体介导的内吞作用。这一过程可以依赖多种方式发生,比如有的依赖网格蛋白和小窝蛋白,但并非都需要依赖网格蛋白。此外,一种小的GTP结合蛋白-RAC1在促进病毒入胞过程中也发挥关键作用,被称为巨胞饮作用(micropinocytosis)。多项研究报道表明,网格蛋白、小窝蛋白或巨胞饮作用可能在一定程度上影响rAAV的转导,但它们对于rAAV转导不是必需的(图1B)。这提示了,多种内化途径可能共存,特定内化途径取决于宿主细胞类型、受体/共受体的特异性及rAAV血清型的不同。
rAAV进入细胞后,进入早期内涵体(early endosomes, EEs)、晚期内涵体(late endosomes, LEs)和高尔基体(Golgi)中,rAAV进入内涵体是病毒有效转导的关键步骤,rAAV的胞内运输需要借助内涵体的酸化过程。研究发现,宿主细胞类型和病毒剂量影响rAAV进入内涵体。泛素化-蛋白酶体系统、自噬和内质网相关蛋白降解(ERAD)会影响rAAV转导,病毒的构象发生变化或衣壳蛋白局部变性,导致病毒能被泛素化,这是病毒颗粒降解的信号。rAAV衣壳蛋白泛素化具有组织特异性,且不同rAAV血清型对泛素化-蛋白酶体系统敏感性不同。蛋白酶体抑制剂可以提高不同rAAV的转导效率。
目前对于rAAV的入核机制尚无统一结论,主要有两种不同的看法:其一,rAAV在进入细胞核之前,会从内涵体或反面高尔基体管网状结构(trans-golgi network, TGN)逃逸到细胞质中,并在核周间隙处(perinuclear space)聚集,裂解,随后DNA基因组进入细胞核(图1D)。其二,也有研究认为rAAV通过核孔复合体(nuclear pore complexes, NPCs)以完整的病毒颗粒进入细胞核内,并在核内完成脱壳,而不是被动扩散进入核。一旦进入细胞核,rAAV基因组就从衣壳中释放出来,也有可能是病毒颗粒在入核之前或期间释放了DNA基因组。为了实现外源基因的表达,单链AAV(ssAAV)基因组可以通过互补链合成或碱基配对使正负链杂交的方式复制成为双链DNA后表达目的基因,这一过程为rAAV转导过程中的限速步骤,新合成的中间体dsDNA的稳定性也是一个限制因素。自互补AAV(Self-complementary AAV, scAAV)是在rAAV的基础上将其编码区域设计成双链DNA,感染细胞后互补部分互补形成双链DNA,不需等待第二链DNA合成,取消了rAAV基因表达的限速步骤,因此scAAV感染后3-5天即可到达表达高峰,同时在部分细胞中观察到了更高的转导效率。rAAV DNA基因组的释放、转录及表达取决于rAAV血清型和宿主细胞类型。例如,在Hela细胞中,与rAAV2和5相比,rAAV1是较快在核内脱壳的,但由于DNA基因组释放效率低,rAAV1的转导率最低。此外,在小鼠肝脏中,rAAV2、6和8进入细胞核并在核内脱壳的速度类似,但rAAV6和rAAV8的转导效率明显更高。
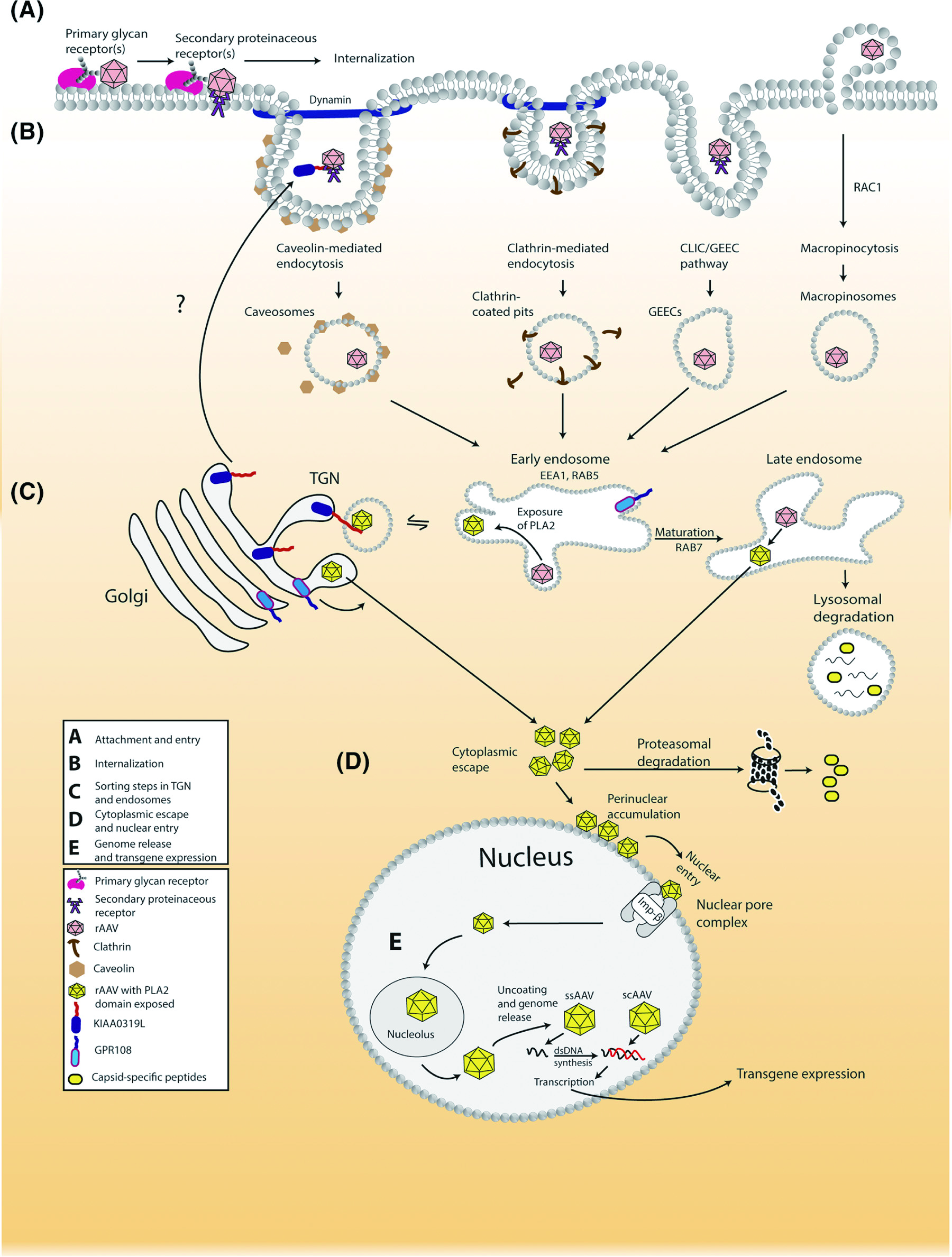
图1 rAAV细胞转导机制
rAAV侵染细胞时,先与细胞表面特异性受体结合,激活胞内信号通路,进而触发AAV通过受体介导的内吞作用进入细胞,经过内涵体、高尔基体等细胞器的协助下进入细胞核,病毒裂解释放基因组,其单链DNA需复制成为双链DNA后表达目的基因。了解rAAV细胞转导机制将有助于更精准地以细胞/组织特异性的方式调控基因的表达,提高rAAV转导效率,增加临床试验中rAAV基因治疗的成功。同时,选择稳定、高质量的病毒包装体系开展病毒制备亦对基因研究的顺利进行至关重要。
和元生物践行“赋能基因治疗,共守生命健康”的使命,以核心技术升级、工艺开发升级、成本控制升级,提升基因递送载体的产品可及性。即日起, AAV包装低至3980元起,用实业回报社会、用科技振兴行业,让基因递送触手可及!

基于>10年、>10万次、>3万种的病毒生产经验,和元生物生产的每一个rAAV都经历数十道工序的锤炼,随机检测的rAAV空壳率<2%、内毒素<2.5EU/mL;同时,每批rAAV产品在出库前均会进行多轮滴度测定,保证产品的滴度准确,更好地指导实验研究。此外,我们使用大规模GMP级病毒包装质粒,用于研究级rAAV病毒载体的生产,全力减少批次间差异,降低杂质及污染,让基因递送触手可及!
未来,我们将以“元载体·GENEDELIVERY”的全新形象为大家提供精准、高效、多元、快速、可靠的病毒载体产品,让和元的“元”载体为你创造无限的可能和未来!

别人只追求滴度的时候,我们还追求更有效;
别人只追求纯度的时候,我们还追求更安全;
别人只追求承诺的时候,我们还追求更真实;
别人只追求周期的时候,我们还追求更稳定;
更多活动详情可长按或扫描下方二维码,填写表单,我们将尽快安排专人与您联系!

参考文献
[1]Bijay P Dhungel, Charles G Bailey, John E J Rasko., Journey to the Center of the Cell: Tracing the Path of AAV Transduction. Trends Mol Med. 2021 Feb;27(2):172-184.





