
期刊:SCIENCE TRANSLATIONAL MEDICINE
影响因子:17.1
导语
中、大弹性动脉的自身免疫性血管炎可导致失明、中风、主动脉弓综合征和主动脉瘤。该疾病通常难以接受免疫抑制治疗,并主动脉炎的形式持续进展。然而血管壁中的肉芽型的炎症浸润是如何被维持的,以及组织浸润的T细胞和巨噬细胞是如何被补充的,目前尚不清楚。本研究中利用血管动脉中免疫细胞群的单细胞转录组学测序确定了一个具有干细胞样特征的CD4+ T细胞群。CD4+ T细胞提供组织浸润和组织损伤效应T细胞存活在三级淋巴结构(TLS)外膜血管,表达转录因子T细胞因子1(TCF1),并产生两个效应群体,EOMES+T细胞和BCL6+ T滤泡辅助细胞。在连续移植实验中,表达白细胞介素7受体(IL-7R)的TCF1hiCD4+ T细胞持续发生血管炎。因此,TCF1hi CD4+ T细胞作为疾病干细胞,促进自身免疫性组织炎症的慢性和自主性进展,所以治疗将需要靶向干细胞样CD4+ T细胞,而不是仅仅针对效应T细胞。
技术服务
单细胞转录组学测序、单细胞TCR免疫组库测序、RNA-seq
研究内容
1. 大血管炎中的三级淋巴结构
主动脉炎样本均显示外膜微血管周围有密集的单核细胞聚集(图1A),该表型仅局限于主动脉伴血管炎,且仅在疾病对照组和主动脉炎组中存在(图1B)。单核聚集物的免疫荧光成像可识别出T细胞和B细胞(图1C),主动脉由三个不同的区域组成:T细胞区、B细胞区和T/B混合区。B细胞区通过CD21+滤泡树突状细胞(DC)网络被识别,其中一些包含干细胞中心(图1C和1D)。大多数的主动脉TLS主要由T细胞和B细胞组成,但约25%主要包含T细胞(图1D、E和F)。大多数TLS处于晚期成熟阶段,有不同的T或B细胞区域(图1E),淋巴结的结构。TLS形成于血管外膜,很少在间质中出现(图1G至I),且主要含有CD4+ T细胞(图1F)。主动脉TLS富含CD11c+树突状细胞(图1G)。T细胞与抗原呈递的HLA-DR+细胞有密切的接触(图1H)。对TLS驻留细胞的分析显示,足蛋白+淋巴管通过IL-7的产生促进T细胞的存活(图1I),主动脉TLS的一个显著特征是高密度微血管的存在(图1J),在T细胞区域明显(图1K)。小动脉和小静脉都可以作为TLS引导血管,其中许多表达外周淋巴PNAd蛋白(图1L),这是内皮小静脉(HEV)的标志物。PNAd+内皮细胞包裹着渗出的T细胞团块,紧挨着排列在血管壁平滑肌细胞层之间的T细胞(图1M-P)。TLS作为内皮下淋巴细胞的延伸区域,EC形成和T细胞聚集是主动脉壁TLS发生过程中的早期原因。

图1
2. 炎症状态下的主动脉壁表达TLS转录组特征
为了表征与主动脉自身免疫相关的免疫反应,对42个主动脉瘤样本进行了全组织RNA测序(RNA-seq)分析。无监督主成分分析(PCA)显示,主动脉炎组与疾病对照组明显分离(图2A)。两组间共有1070个基因存在差异表达(P值为<0.05)(图2B)。差异表达基因功能富集(DEGs)显示了主动脉炎中适应性免疫激活通路的富集(图2C)。分层聚类提供了主动脉炎组与疾病对照组和正常主动脉组织的基因差异(图2D)。主动脉炎的病例包括GCA患者,对照组动脉瘤是由动脉粥样硬化或遗传性主动脉病变引起。潜在的疾病过程并不影响22个TLS相关基因转录本的表达模式(图2E)。CXCL13和CCL19表达上调,而CCL21表达不上调,并与单核细胞聚集物的大小密切相关(图2F-G)。组织浸润性CD45+免疫细胞在主动脉炎中高度富集,为了捕获与结构淋巴滤泡形成相关的细胞元素,我们对大量RNA-seq数据进行了细胞分类分析(图2H)。这两种组织来源的细胞都表达了静息CD4+记忆T细胞和单核细胞的基因模式。活化的CD4+记忆T细胞和记忆B细胞只见于主动脉炎(图2H)。值得注意的是主动脉炎中大多数组织浸润性T细胞处于静息状态(图2I)。
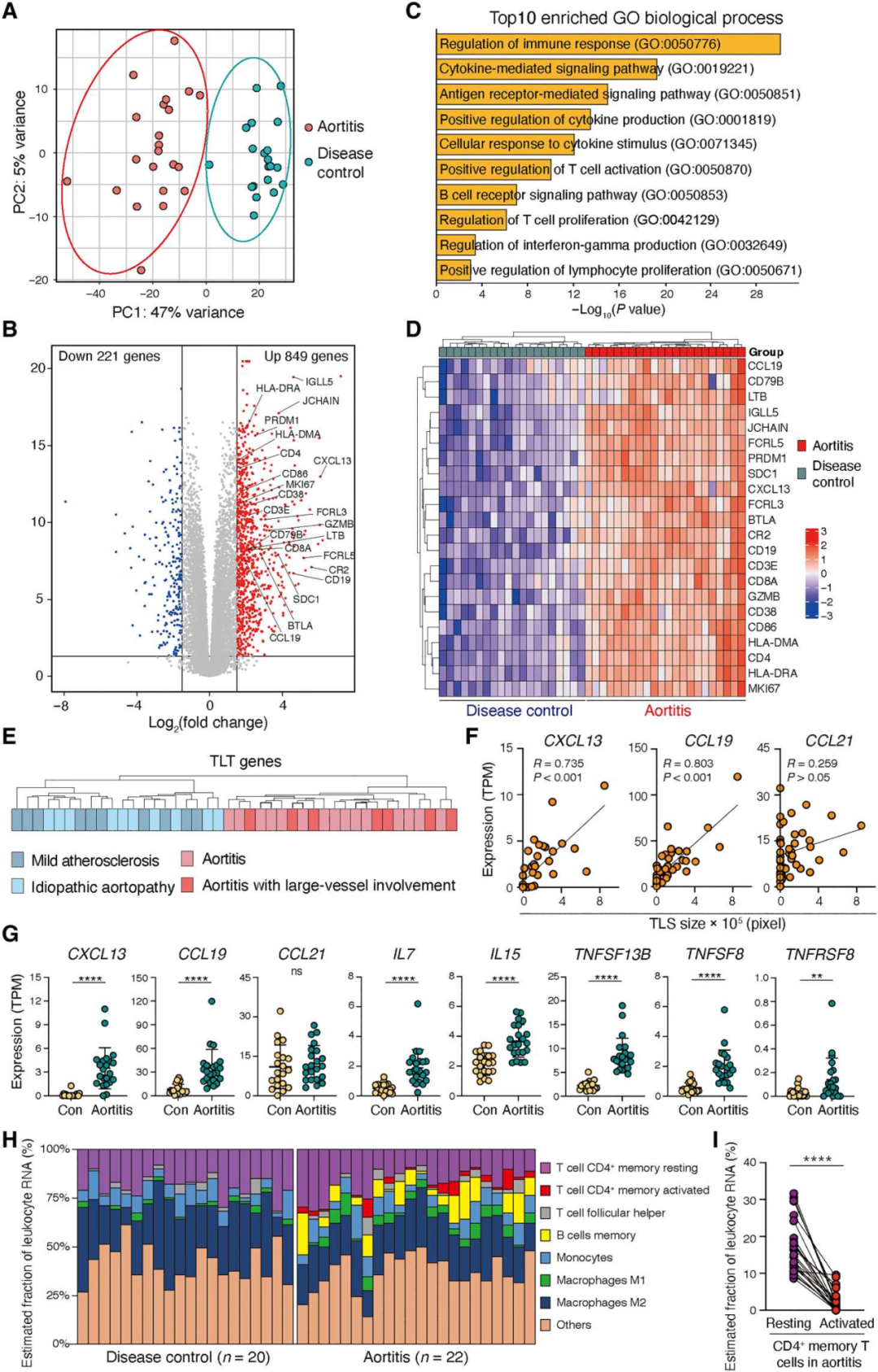
图2
3. scRNA-seq定义血管源性CD4+ T细胞的多个亚群
为了阐明参与自身免疫性血管炎的CD4+ T细胞的异质性,从未暴露于免疫抑制治疗的动脉中分离出组织CD4+ T细胞。再移植到免疫缺陷非肥胖糖尿病小鼠(NOD)严重联合免疫缺陷(SCID)(NSG)小鼠的动脉中诱导血管炎,scRNA-seq转录本的聚类产生了5个聚类,5个聚类之间的差异基因表达分析显示,它们的转录组谱存在显著差异(图3A-C)。基于以上结果,将cluster命名为:TCF1hi CD4+ T cells (cluster 0), TFH-like T cells (cluster 1),cycling (clusters 2 and 4)和 cytotoxic CD4+ T cells (cluster 3),TCF1hi CD4+ T cells 缺乏关于tox驱动的衰竭的转录本和细胞毒功能(图3E)。尽管抑制标志物如TOX、PDCD1和TIGIT高表达(图3E-F),细胞毒性CD4+ T细胞翻译了更高数量的TBX21和IFNG,使它们能够提供效应功能(图3E-F)。表达foxp3的CD4+调节性T细胞明显罕见(图3E)。TCF1hi CD4+ T细胞表达TGFB1和SMAD3转录本(图3G),这与转化生长因子β(TGF-β)信号可以促进T干和组织Trms的发育的观点一致。在支持方面,TCF1hi CD4+ T细胞富集了整合素家族基因且表达LTB,而这对TLS的支持与发育至关重要(图3H)。
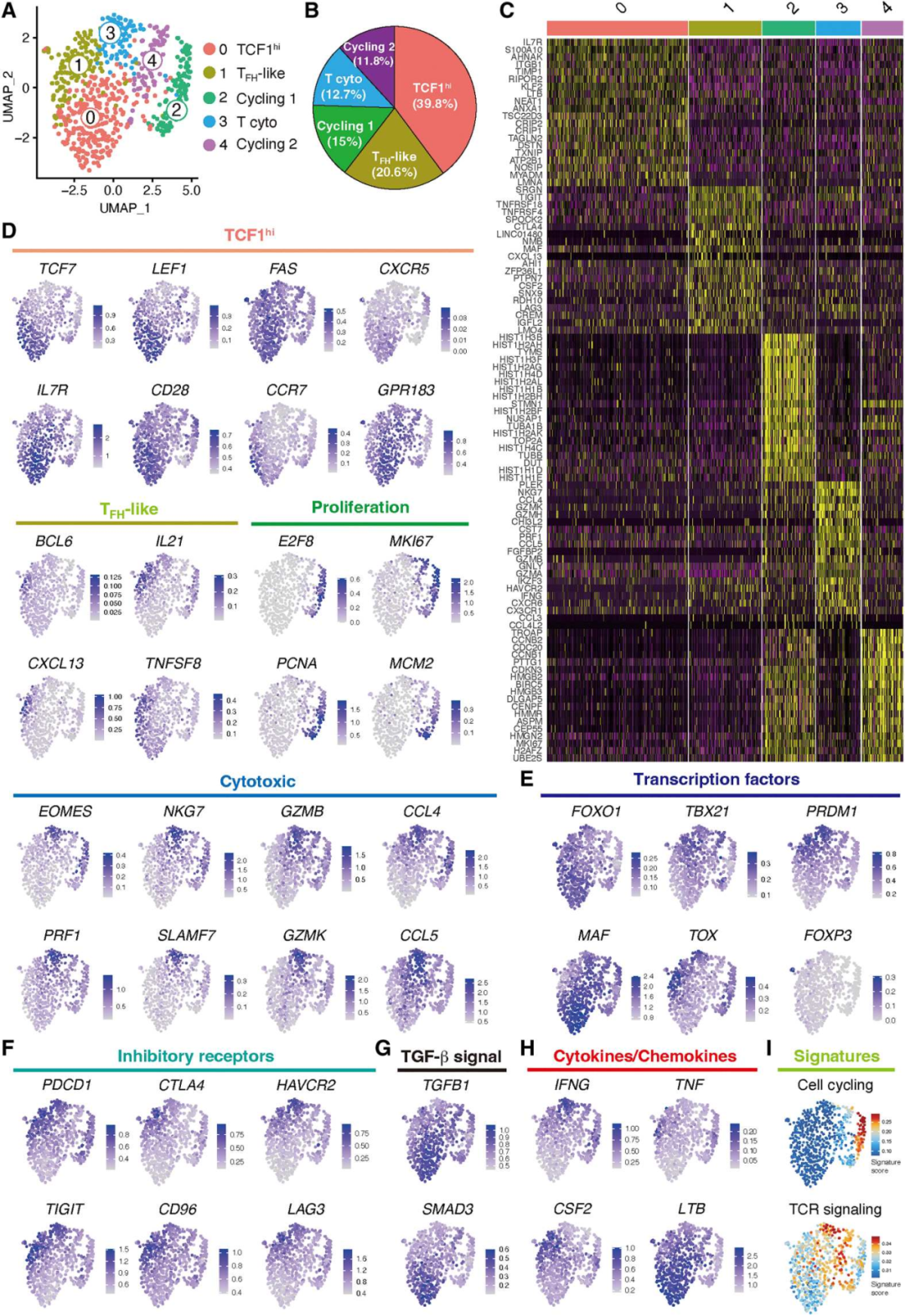
图3
4. 不同的血管源性CD4+ T细胞亚群共享TCR克隆
为了探索上述CD4+ T细胞亚群之间的潜在谱系关系,使用Monocle3进行了拟时序分析。细胞轨迹从TCF1hiCD4+ T细胞开始,随后分为三个分支,其中两个分支发展为两个不同的效应细胞群,TFH样细胞和细胞毒性CD4+ T细胞。第三个分支产生了循环的CD4+ T细胞(图4A)。单细胞TCR序列(scTCR-seq)分析,并检测了TCR克隆型在5个不同的T细胞群之间是否共享。超过40%的TRA和TRB均有克隆扩增,并且在所有5个T细胞簇中均存在扩增的克隆型(图4D-E)。通常,扩增的克隆型在不同的CD4+ T细胞亚群之间是共享的(图4F)。TCF1hi CD4+ T细胞与所有其他CD4+ T细胞簇共享TCR克隆型(图4G-H)。这些结果支持了CD4+ TCF1hi T细胞具有高可塑性和自我更新能力,并可产生分化的效应T细胞。
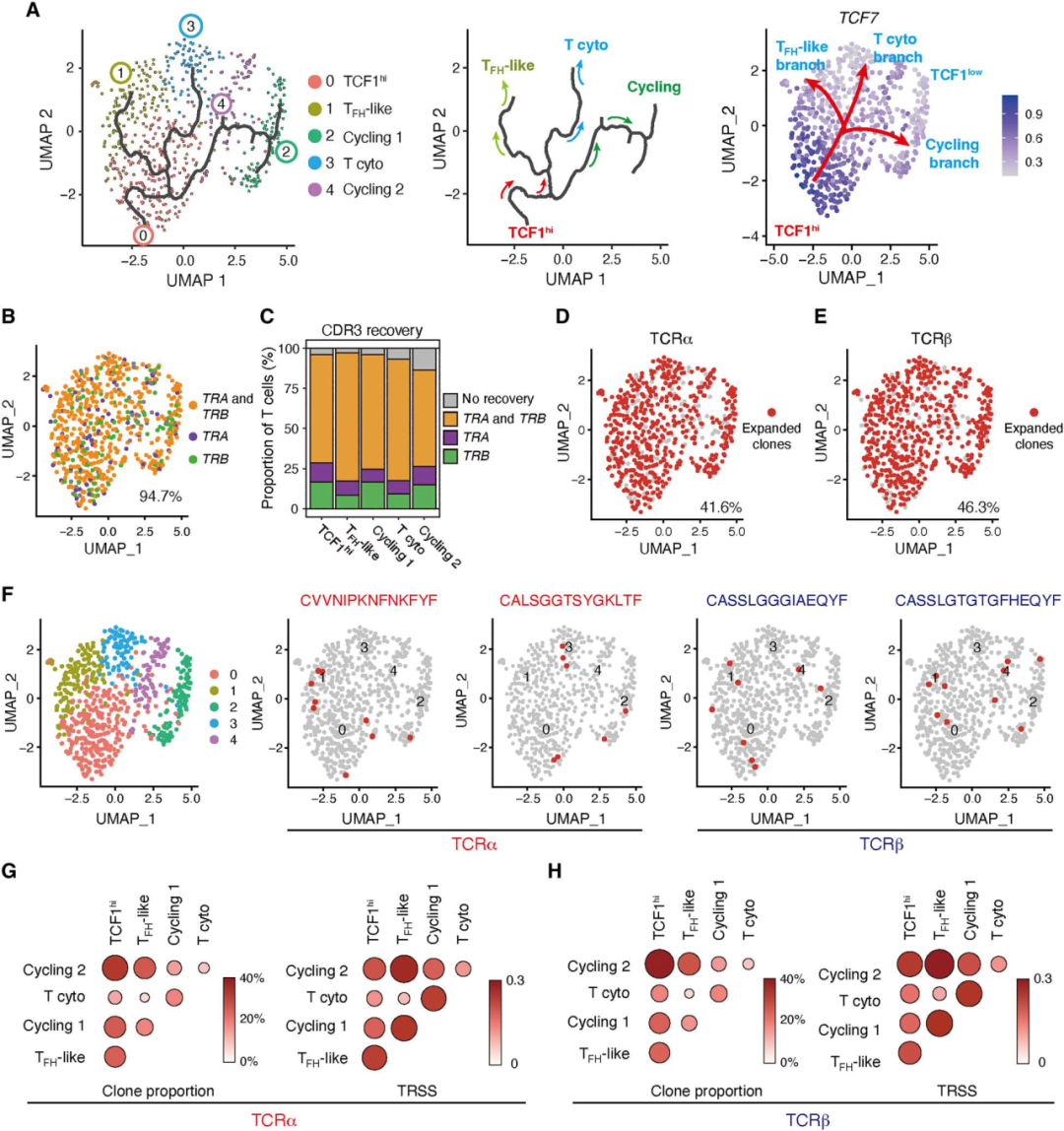
图4
5. TCF1的表达与T细胞分化状态相关
探讨TCF7表达和效应分子表达的T细胞在组织病变中是否仍然存在的区别?TCF7在组织来源的CD4+ T细胞中的表达与TBX21、EOMES、IFNG、GZMB等几种效应分子的表达呈负相关(图5A)。在PBMCs中,T-box转录因子(TBX21)的表达,也被称为T-bet,通常与效应分化相关,与主动脉炎患者和对照组的CD4+和CD8+ T细胞中的TCF1蛋白表达呈负相关(图5B-C)。在自身免疫性疾病过程中功能性地表征TCF1hi和TCF1lo CD4+ T细胞,检测了老年健康成年人(64至83岁)的T细胞亚群中TCF1的表达。在CD4+和CD8+ T细胞中,幼稚和中央记忆T细胞(TCM)通常表达的TCF1蛋白高于效应记忆T细胞(TEM)和效应记忆CD45RA+ T细胞(TEMRA)(图5D),表明TCF1表达是低分化T细胞的特征,即使在老年人中也是如此。我们探讨了TCF1hi T细胞对TCR刺激的反应。从老年人中分离出幼稚性和记忆性CD4+ T细胞,用细胞追踪标记,并刺激其增殖。初始CD4+ T细胞的后代在增殖细胞中保持高的TCF1表达。最终出现了TCF1lo亚群(图5E-F)。令人注意的是,患者来源的T细胞倾向于非效应T细胞。与健康对照组相比,患者的非效应CD4+ T细胞(幼稚+传统细胞)比例较高,TEMs和TEMRAs比例较低(图5G)。在CD8+ T细胞中也观察到类似的现象(图5H)。

图5
6. TCF1hi CD4+ T细胞优先定位于TLS
为了验证通过组织来源的CD4+ T细胞的scRNA-seq获得的结果,我们回到主动脉组织,并定位了通过转录组学确定的功能T细胞亚群。免疫荧光分析发现了TLS中的TCF1hi T细胞(图6A)。TCF1在T细胞中的表达是可变的,从高信号表达到低信号表达(图6A)。为了明确T细胞位置与TCF1表达之间的关系,我们测定了TCF1hi和TCF1lo T细胞在三个位置的比例:外膜TLS、外膜非TLS区和内侧腔室。超过50%的TLS驻留的T细胞的TCF1强阳性(图6A-C)。其他区域有80%以上的T细胞为TCF1lo(图6A-C)。同样,TCF7的表达与TLS的大小相关(图6D)。为了研究当TCF1hi T细胞被放置在TLS时,它们的高增殖潜能是否保持。增殖标志物Ki67的免疫荧光将增殖的CD4+和CD8+ T细胞定位在外膜层(图6E-H),TLS(图6I-J)。细胞毒性CD4+ T细胞,定义为EOMES+ CD4+ T细胞,同时存在于TLS的内外区域(图6K)。免疫荧光发现了生发中心内的TFH样细胞(图6L)。IFNG、IFNGR1和IFNGR2转录本在主动脉炎病例中有差异表达,GSEA为疾病病变中持续进行的II型干扰素(IFN)信号通路提供了进一步的证据(图6M-N)。

图6
7. TCF1hi T细胞在特定的细胞环境中存活
为了进一步表征TCF1hi CD4+ T细胞的组织生态位,确定了TCF1hi CD4+ T细胞在TLS中的空间分布。TCF1hi CD4+ T细胞同时归巢于T细胞区和T/B混合区(图7A-D)。在淋巴结中,DC网络在T细胞-B细胞区边界特别密集,CD11c+DC的树突状细胞定位于T细胞区(图7E-G)。在TLS中的CD11c+DC形成了广泛的网络,为T细胞的存活创造了一个特殊的环境(图7E-G) 。还观察到Ki67+ CD11c+树突状细胞,表明它们能够在TLS中增殖(图7H)。最后,CD11c+树突状细胞经常被包裹在内皮细胞周围,为免疫与内皮两种细胞类型之间建立细胞网络(图7I-J)。
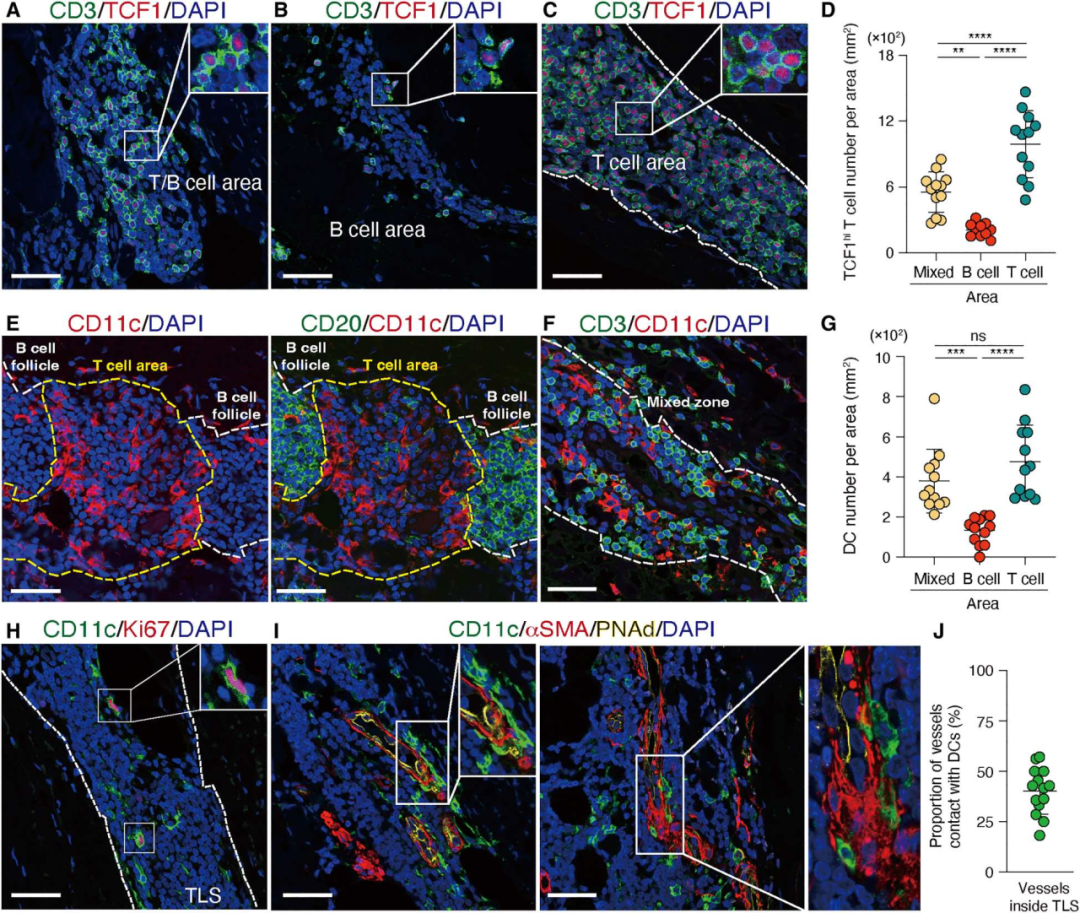
图7
8.TCF1hiCD4+ T细胞可作为疾病干细胞发挥致病作用
我们首先鉴定了IL-7受体(IL-7R)作为一种与TCF7高表达相关的可分类的表面标记物(图8A)。IL-7R的表达仅限于T细胞(图8B),高表达TCF1可区分IL-7R+T和IL-7R−T细胞(图8C)。利用IL-7R作为TCF1hi CD4+ T细胞的替代标记物,我们通过耗尽IL-7R+细胞生成表达TCF1lo的GCA PBMCs。然后,我们通过含IL-7R(IL-7R+)和IL-7R耗尽(IL-7R−)PBMCs的过继转移,在人源化NSG小鼠中诱导血管炎(图8D)。将炎症动脉内的T细胞从血管外淋巴组织(主要是NSG小鼠的脾脏)中分离出来,我们将炎症动脉细胞连续移植到“空”小鼠中,而没有移植其他的人类细胞(图8D)。监测原发性和继发性接受者血液和脾脏中的人类T细胞数量(图8E)。通过组织学评分,评估炎症的严重程度和扩散以及血管损伤的程度,IL-7R+细胞的PBMCs诱导的血管炎严重程度明显加重(P<0.001)(图8F-G),表明TCF1hi T细胞的致病相关性。我们评估了IL- 7R+ TCF1hi T细胞对血管重塑的影响,从血管炎诱导的免疫细胞群中去除IL-7R+细胞显著降低了VEGFA转录,并减少了移植物新血管生成(图8H-J)。IL-7R+ T细胞群诱导的动脉炎症富含T细胞,包括高增殖率(Ki67+)T细胞(图8K-L)。IL-7R+细胞的消耗导致低级别壁炎症,缺乏两种主要效应分子IFNG和GZMB的转录本(图8M)。总之,这些数据表明,TCF1hiCD4+ T细胞诱导可转移性和持续性血管炎,并将其指定为疾病干细胞。
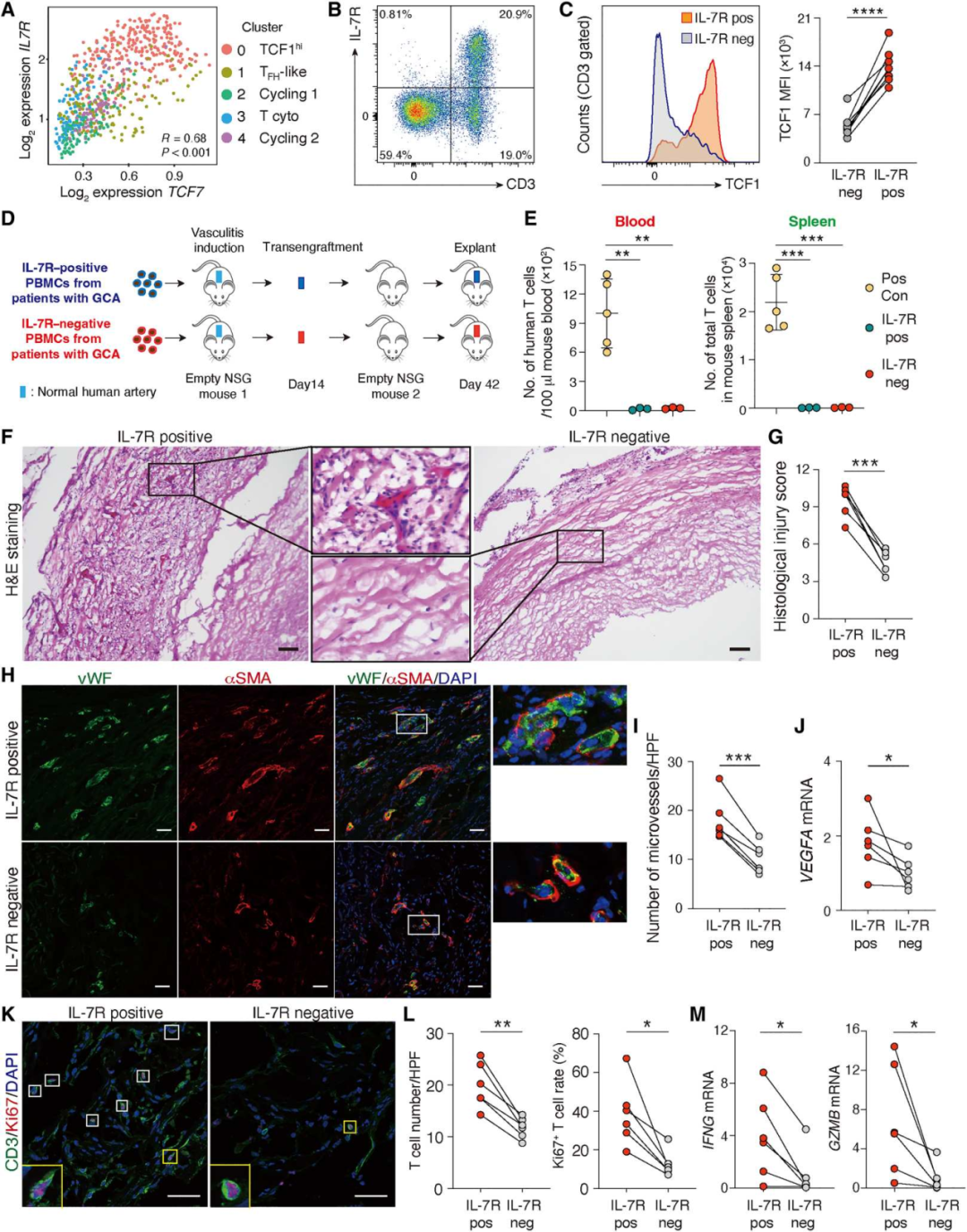
图8
参考文献:
[1]Sato et al. Stem-like CD4+ T cells in perivascular tertiary lymphoid structures sustain autoimmune vasculitis[J]. Sci Transl Med, 2023,9.6:15,eadh0380.
