蛋白间相互作用是细胞各种基本功能的主要完成者,参与几乎所有的重要生命活动。因此,蛋白-蛋白相互作用研究以及建立相互作用的关系网络图,具有十分重要的意义,也是目前蛋白质研究领域的热点。
亲和纯化结合SWATH(AP-SWATH)技术是近几年发展起来的研究蛋白相互作用的一种重要技术,该技术能够高特异性的准确富集到靶蛋白的特异性相互作用蛋白,并实现复合蛋白质的准确鉴定和定量。
下面就来818如何通过AP-SWATH技术来开展蛋白互作研究之旅!
基本信息
题目:Precise Temporal Profiling of Signaling Complexes in Primary Cells Using SWATH Mass Spectrometry(利用SWATH质谱技术研究原代细胞信号复合体的精确时间图谱)
期刊:Cell Reports
影响因子:8.281
研究背景
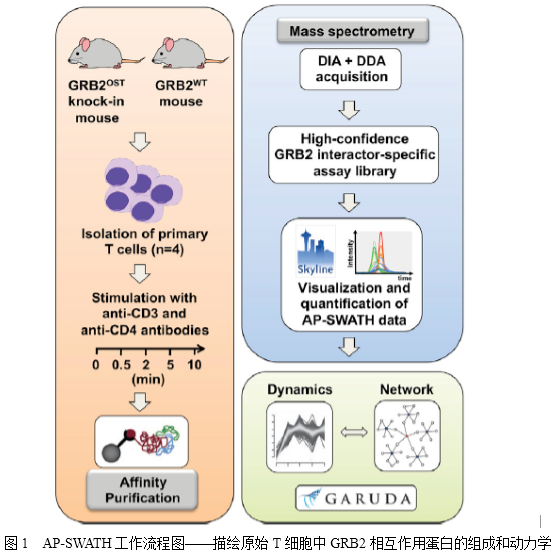
信号通路中蛋白质-蛋白质相互作用的动态组织过程是协调细胞功能以响应外在和内在信号的关键。亲和纯化联合质谱技术(AP-MS)一直是各种模型系统中研究蛋白质-蛋白质相互作用鉴定和蛋白质复合物鉴定的方法。生长因子受体结合蛋白2(GRB2)是由1个SH2结构域和2个SH3结构域构成的必需接头蛋白,其参与调节MAPK信号通路。在T淋巴细胞中,GRB2也是TCR信号通路网络中的一部分,其不仅能够调控T细胞的发育,而且能促成成熟T细胞的活化。鉴于GRB2在信号启动和多样化中的重要作用,在不同的信号级联和细胞类型中形成的信号复合体的组成和动力学是理解其实际功能范围的关键。因此,作者选择GRB2作为评估swath- ms的模型,可以在两种原始细胞中快速、可靠、准确地定量分析蛋白质相互作用动力学(图1)
研究内容及结果
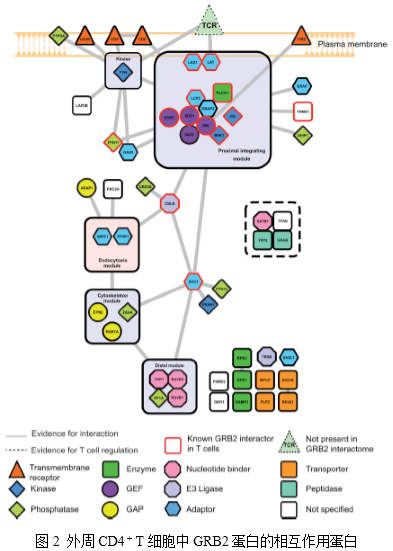
1. 绘制外周CD4 + T细胞中GRB2的相互作用图谱
作者利用AP-SWATH鉴定了在TCR介导的原代小鼠T细胞激活之前或之后与GRB2相互作用的蛋白质。经分析,获得658 个蛋白(FDR<1%),其中53个是具有高可信度的GRB2相互作用蛋白(图2)。
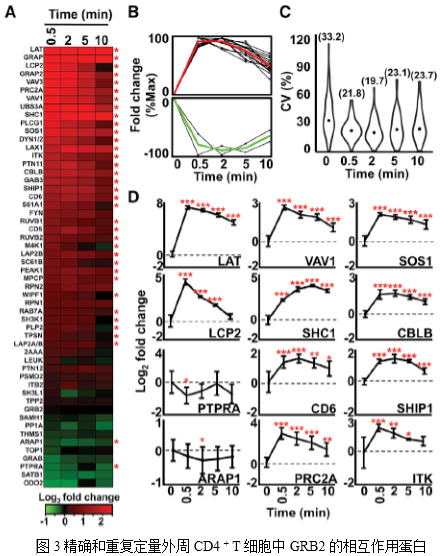
2. 外周CD4 + T细胞中GRB2的蛋白质相互作用组的可重复定量测定
从原代细胞产生高度精确和可重复的AP-SWATH数据对于理解生理层面的动态复合物形成至关重要。本文作者评估了AP-SWATH分析技术的重现性,以量化TCR介导的T细胞活化0.5min,2min,5min和10min后GRB2蛋白相互作用组的动力学变化。AP-SWATH的目标分析数据是由之前鉴定的604个肽段和4020 GRB2特异转换体和53个高可信度的GRB2相互作用因子组成。这53个蛋白质在整个时间序列中同时进行量化(图3A), 例如,在T细胞刺激前后,在所有四个生物重复中,中值系数变异(CV)范围为19.7%~33.2%,与使用转化细胞系进行的AP-SWATH研究计算得到的CV值相似(图3C)。值得注意的是,使用30分钟的短液相色谱(LC)梯度对于高度可重现和准确的定量不会产生影响,从而能够提高时间效应实验的通量。因此,可以通过原代小鼠CD4 + T细胞来实现高可信度、高时间分辨的GRB2蛋白相互作用蛋白的鉴定和定量。
3. 对外周CD4+ T细胞中时间分辨GRB2蛋白相互作用的透彻分析
作者利用两个开源软件系统分析了AP-SWATH数据:用于原始数据分析的Skyline中的图形用户界面MSstats和用于进一步数据处理和可视化的Garuda平台,这两个系统都都支持统计学和计算分析的重现性。利用这些软件工具,生成了热图、蛋白质簇和统计数据,证明了在T细胞激活的最初几秒内,GRB2周围形成了复杂的蛋白质组合(图3A,3B)。
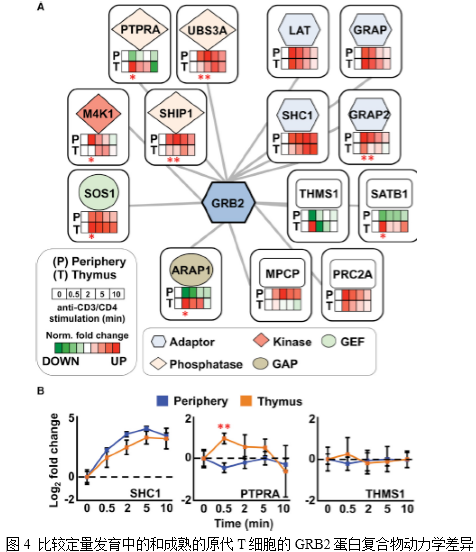
4. 发育中的T细胞和成熟T细胞的GRB2相互作用蛋白存在特定的动力学差异
作者接下来测定了抗CD3和抗CD4抗体活化后的发育中的T细胞和成熟T细胞之间的GRB2相互作用蛋白动力学,观察其是否存在差异。在构成GRB2相互作用的蛋白质中,在发育和成熟T细胞中能同时检测到14个GRB2相互作用因子,因此可用于整个动力学的比较分析(图4)。结果发现,在14个GRB2相互作用因子中,有6个在发育和成熟T细胞之间观察到相似的时间分辨特征(LAT,GRAP,MPCP,PRC2A,SHC1,和THMS1)(图4)。相反,ARAP1、GRAP2、M4K1、PTPRA、SATB1、SHIP1、SOS1、USB3A在发育和成熟T细胞间至少有一个刺激时间点之间存在显著的动力学差异(图4)。
文章小结
蛋白质-蛋白质相互作用的特异性和动态形成是调节细胞信号传导的关键机制。然而在公共蛋白相互作用数据的基础上,正确建立能够反映原代细胞信号系统的通路模型,受系统检索蛋白相互作用数据的方法缺陷影响。该文章引入了AP-SWATH的工作流程来克服这些缺点。文中的结论可以证明所提出的方法具有足够的精确性和稳定性,以准确地探测信号复合物的形成。另外,本文介绍的方法流程可以广泛地应用于各种细胞和组织类型的蛋白相互作用关系的鉴定。
小编告诉您,金开瑞借助高精度质谱平台,结合亲和纯化与Label-free、SILAC或SWATH定量技术,开发了一系列灵活的互作蛋白质组研究策略。目前热门的AP-SWATH流程,灵敏度高、重复性好,非常适合蛋白质相互作用的研究。
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5417)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6216)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7280)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5343)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4099)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:5671)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:9644)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6445)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:4944)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5470)