
期刊:Circulation
影响因子:37.8
导语
发生过程中,平滑肌细胞(SMC)在动脉粥样硬化刺激下,增殖、去分化和迁移到内膜病变中。其转化成其他表型的细胞在冠心病(coronary artery disease,CAD)发病中起到了重要作用,包括转化成类成纤维细胞、类软骨细胞等,这些细胞组成了动脉粥样斑块的主要细胞群。
研究问题
·表观遗传和转录机制如何介导SMC转化为其他细胞
·SMC及转化后的细胞如何影响冠心病的发生
研究技术
10X 单细胞RNA测序、10X单细胞ATAC-seq、ChIP-seq、IHC
研究内容
作者采用CRISPR-Cas9技术,鉴定出远端调控Zeb2表达的超级增强子。Zeb2通过调节染色质重塑,抑制Notch和TGFβ信号通路,改变SMC表观遗传轨迹,调控SMC表型转化。Zeb2的SMC特异性缺失导致SMC无法关闭收缩的表达,呈现出成纤维细胞样(fibromyocyte,FMC)表型,加速了软骨肌细胞(chondromyocyte,CMC)的形成,反映了人类冠状动脉中高风险动脉粥样硬化斑块的特征。
研究路线
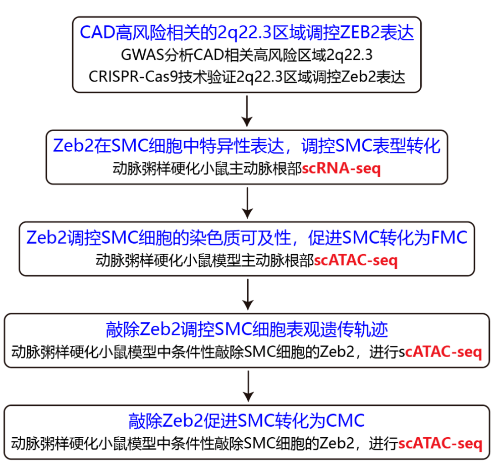
研究结果
1. CAD相关的染色体2q.22.3变异调控ZEB2表达
既往全基因组关联分析发现染色体2q.22.3与CAD的发病率显著相关(Fig 1A),该区域距离最近的基因为ZEB2。GWAS数据分析发现,2q.22.3区域的SNP单倍型块与CAD风险显著相关,且在物种间保守(Fig 1B),并可以划分为6个高保守区域(Fig 1C)。采用人SMC组织进行H3K27ac ChIP-seq发现,该区域属于功能型增强子(Fig 1D),Hi-C证实其行成loop结构结合ZEB2启动子(Fig 1D)。GWAS分析eQTL数据,发现该区域的SNP与CAD发生相关,与ZEB2的表达也明显相关(Fig 1E)。使用CRISPR-Cas9敲除该区域后(Fig 1F),ZEB2表达显著降低(Fig 1G)。使用dCas9-KRAS特异性分别抑制6个保守区域的功能(Fig 1H),发现其中3个区域调控ZEB2表达(Fig 1I)。
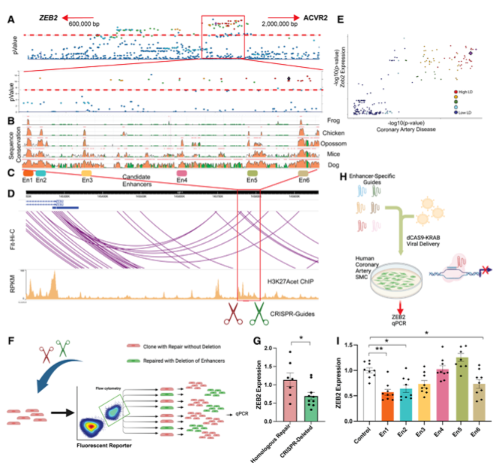
Fig. 1 人CAD相关的染色体2q22.3区域调控ZEB2表达。
2. SMC表型转化中Zeb2表达激活
为了研究在动脉粥样硬化损伤中,表达Zeb2的细胞,作者使用谱系追踪的动脉粥样硬化小鼠模型的主动脉根部进行单细胞测序(Fig 2A)。无动脉粥样硬化时,Zeb2表达于巨噬细胞和成纤维细胞中,谱系示踪的SMC细胞中不表达Zeb2(Fig 2B-2D)。值得注意的是,在动脉粥样硬化斑块中,随着SMC转化,Zeb2表达逐渐激活(Fig 2C)。RNA原位杂交发现,Zeb2表达于斑块帽子结构下方的谱系示踪SMC细胞中(Fig 2E-2G)。
为了鉴定使用ZEB2增强子的细胞,及了解Zeb2如何调控表观基因组,作者进行了单细胞ATAC-seq(scATC-seq)。采用拟表达矩阵进行降维聚类,鉴定出6种细胞(Fig 2H)。不同类型的细胞中可视化2q.22.3区域的染色质开放程度,发现巨噬细胞和内皮细胞中该区域处于关闭状态,转化的SMC细胞中处于开放状态(Fig 2I)。整合scRNA-seq和scATAC-seq中的SMC细胞数据,降维分析发现SMC可以聚类为静息态和转化态SMC(Fig 2J)。Monocle软件构建SMC演化状态(Fig 2K),平滑肌细胞起始于收缩基因高表达状态,随着SMC转化为FMC,其表达量逐渐降低(Fig 2L)。Zeb2表达伴随于Zeb结合位点的可及性降低(Fig 2M-2O)。随着演化轨迹,出现CMC细胞时,Zeb2表达丢失,Zeb结合基序的可及性恢复。这些结果表明,Zeb2作为表观遗传抑制因子,结合染色质后,会关闭其结合区域的染色质可及性(Fig 2P)。
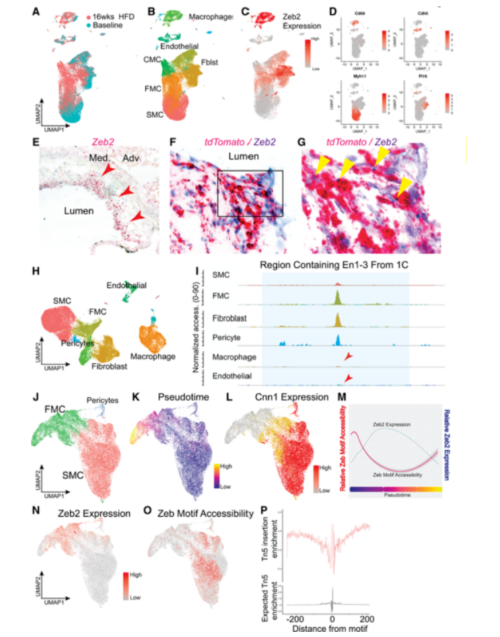
Fig. 2 Zeb2降低染色质可及性调控SMC细胞表型转化
3. 敲除Zeb2特异性调节转化态SMC的表观遗传轨迹
对SMC细胞条件性敲除Zeb2的动脉粥样硬化小鼠进行scATAC-seq和scRNA-seq,研究Zeb2调控SMC转化的机制(Fig 3A)。scATAC-seq降维聚类发现(Fig 3B),缺失Zeb2广泛改变转化态SMC细胞的染色质可及性(Fig 3C)。SMC细胞亚群细分,转化态SMC主要存在于Zeb2敲除的样本中(Fig 3D-3E),成熟SMC标记基因Cnn1等的染色质可及性增加(Fig 3F-3G),意味着Zeb2在转化态SMC中具有抑制成熟SMC标记基因的作用,还可能抑制SMC转化为软骨细胞表型。差异开放区域也富集了Notch和TGFβ的效应因子Rbpj和Smad结合基序(Fig 3H),Zeb2的表达与Notch靶基因的表达也呈现负相关关系(Fig 3I)。GREAT算法发现,Zeb2最可能的靶基因富集于EMT相关通路和TGFβ信号通路(Fig 3J),说明Zeb2可直接调控TGFβ响应基因。
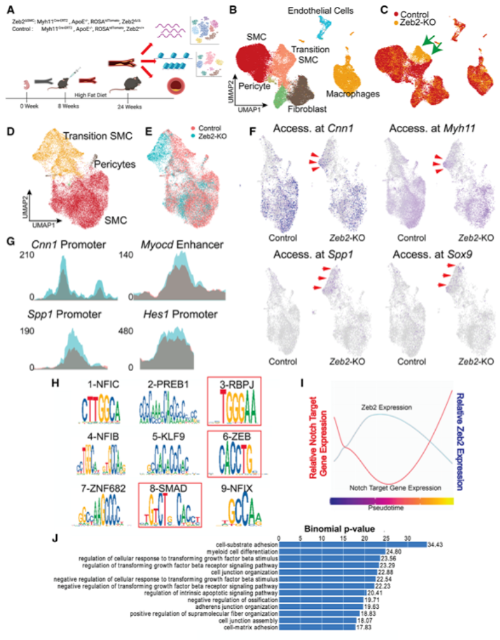
Fig. 3 缺失Zeb2改变SMC的表观遗传轨迹
4. SMC特异性敲除Zeb2降低斑块中的转化态SMC细胞
scRNA-seq降维聚类发现,缺失Zeb2只导致转化态SMC的转录组和表型变化(Fig 4A-4C)。对谱系追踪的SMC细胞亚群细分,缺失Zeb2显著降低转化态SMC细胞数目(Fig 4D-4I),总SMC细胞数不变的情况下,CMC细胞百分比增加,FMC细胞百分比降低(Fig 4H-4I),敲除Zeb2促进SMC向CMC转化,类成纤维细胞的重塑态SMC基因MMP3和Cxcl12表达降低(Fig 4K-4N)。RNA原位杂交显示,Zeb2敲除时,成熟SMC基因Cnn1分布于斑块帽子区域(Fig 4O-4R),软骨标记基因Col2a1在靠近纤维帽区域的斑块体中的细胞中表达(Fig 4S-4T)。
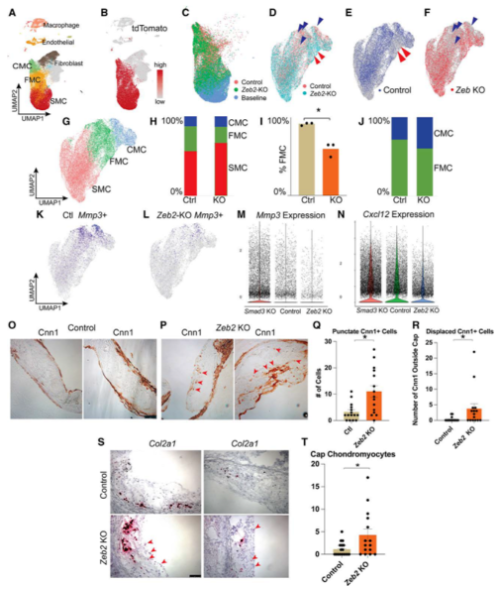
Fig. 4 缺失Zeb2抑制SMC转化为FMC,促进转化为CMC。
文章结论
本研究通过GWAS确定了ZEB2作为新的CAD相关基因,scRNA-seq和scATAC-seq发现ZEB2特异性调控SMC细胞的基因表达和染色质可及性,促进SMC转化为FMC,抑制SMC转化为CMC。
参考文献:
Cheng P, Wirka RC, Shoa Clarke L, Zhao Q, Kundu R, Nguyen T, Nair S, Sharma D, Kim HJ, Shi H, Assimes T, Brian Kim J, Kundaje A, Quertermous T. ZEB2 Shapes the Epigenetic Landscape of Atherosclerosis. Circulation. 2022 Feb 8;145(6):469-485. doi: 10.1161/CIRCULATIONAHA.121.057789. Epub 2022 Jan 6. PMID: 34990206; PMCID: PMC8896308.
