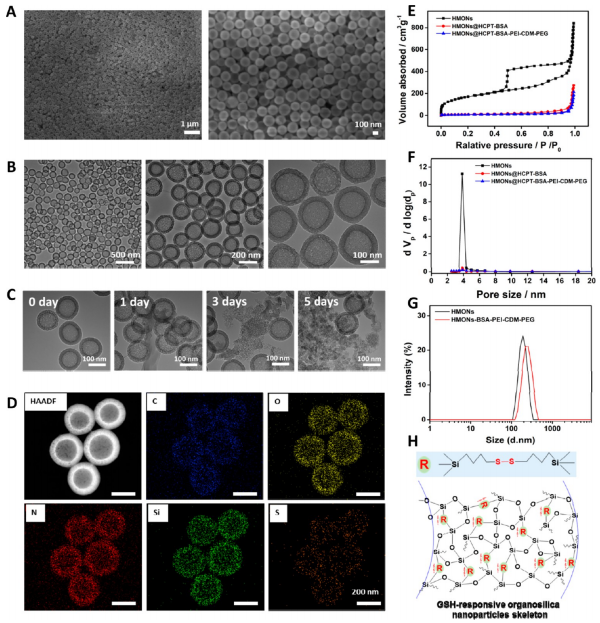
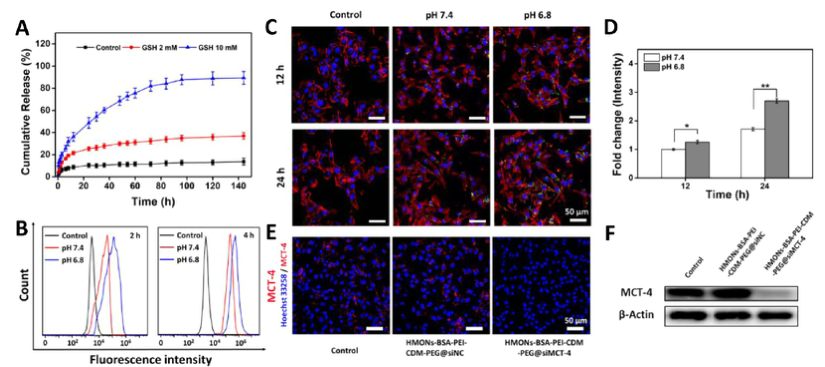
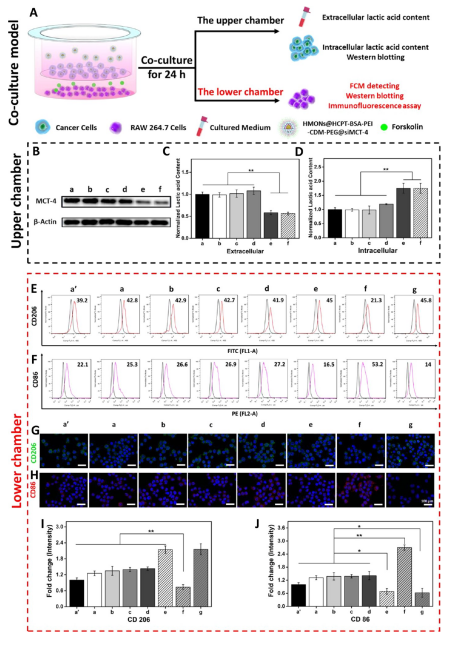
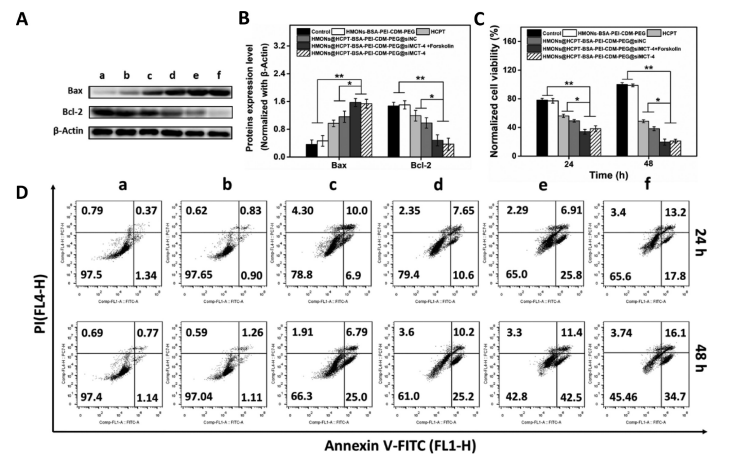
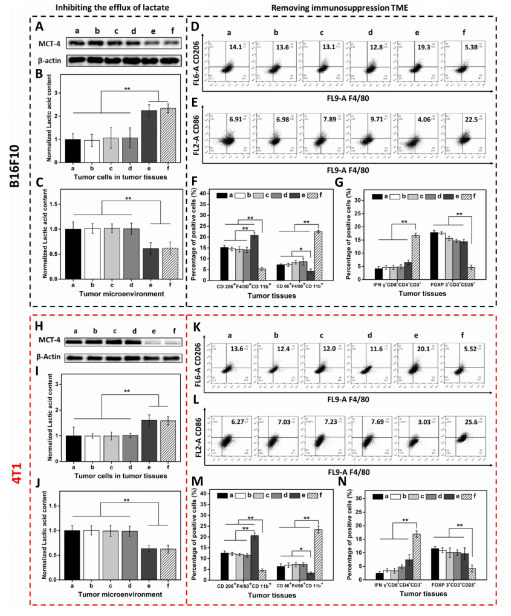
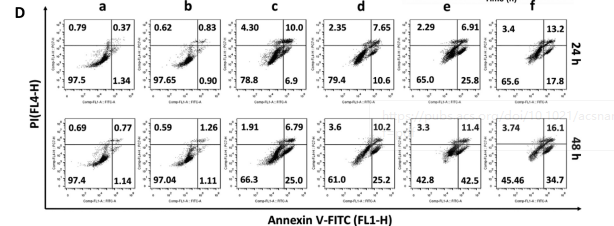
在免疫抑制的TME中,高水平的乳酸通过促进肿瘤相关巨噬细胞(TAM)表型向M2型极化和抑制CD8+T细胞活性来促进肿瘤细胞免疫逃逸。因此,肿瘤源性乳酸作为免疫抑制TME的免疫调节因子,是未来最有潜力的肿瘤免疫治疗靶点。作为一种单羧酸转运体(MCT),沉默MCT-4的表达可以增加细胞内乳酸含量来诱导肿瘤细胞凋亡,并降低细胞外乳酸含量来调节TME。联合化疗和抑制乳酸外排可能具有良好的体内抗肿瘤疗效。 响应谷胱甘肽(GSH)的生物可降解介孔有机硅纳米颗粒(MONs)是抗癌药物传递的候选材料之一,通常采用二硫键(−S-S-)作为中间连接剂来制备硅网络。基于前人研究显示的中空MONs(HMONs)巨大的应用潜力,作者寻求将可生物降解的HMONs作为一种多用途的纳米给药平台,用于协调化疗和免疫治疗,以获得更大的治疗效益。 重庆大学蔡开勇教授和西南大学罗忠教授团队提出了通过抑制乳酸外流和化疗的联合作用,消除免疫抑制性TME,将免疫抑制性肿瘤转化为“热”性肿瘤,并取得最佳抗肿瘤疗效的有效策略。通过在血液循环、肿瘤摄取和细胞内释放的顺序递送阶段调控激活,纳米平台可以提供平衡的安全性和治疗性能。此外,纳米平台可以诱导免疫促进因子的表达,并激活免疫应答来抑制肺转移。 基本信息 题目: Engineering of Cascade-Responsive Nanoplatform to Inhibit Lactate Efflux for Enhanced Tumor Chemo-Immunotherapy 期刊:ACS NANO 影响因子:14.588 PMID:32975406 通讯作者:蔡开勇教授和罗忠教授为共同通讯作者 作者单位:重庆大学和西南大学 索莱宝合作产品: 产品名称 产品货号 ANNEXIN V- FITC/PI 凋亡检测试剂盒 摘 要 乳酸作为肿瘤中高速有氧糖酵解的增加产物,可以调节免疫抑制的肿瘤微环境(TME)。将羟基喜树碱(HCPT)和siMCT-4负载于经PEG-CDM表面修饰的、GSH响应型中空介孔有机二氧化硅纳米平台,用于协同肿瘤化疗免疫治疗。此纳米平台对肿瘤细胞弱酸性TME和高水平GSH有级联反应。HCPT和siMCT-4从纳米平台持续释放,用于化疗和抑制细胞内乳酸外流。细胞内乳酸和HCPT升高可有效诱导肿瘤细胞凋亡。而细胞外乳酸的降低使肿瘤相关巨噬细胞(TAMS)的表型由M2型转变为M1型,并恢复了体内CD8+T细胞的活性。结果表明,纳米平台通过抑制乳酸外流与化疗联合作用,有效地清除了免疫抑制TME,抑制了肿瘤生长,且抑制了B16F10细胞和4T1细胞的肺转移。这是一种将免疫抑制肿瘤转化为“热”瘤,并在体内高效抑制肿瘤生长的策略。 研究内容及结果 1.响应GSH降解的纳米颗粒的合成与表征 首先在前人研究的基础上合成了固体二氧化硅纳米颗粒(记为sSiO2 NPs)。之后,以sSiO2 NPs为基础合成了中空介孔有机硅纳米颗粒(命名为HMONs)。BSA用于阻断装载在HMONs中的HCPT(HMONs@HCPT-COOH),以降低纳米颗粒对正常细胞的细胞毒性。实验表明,BSA能稳定地在HMONs表面组装。 为了有效的加载siMCT-4,PEI被装载到HMONs@HCPT-BSA-COOH的表面。最后,将PEG-CDM引入HMONs@HCPT-BSA-PEI表面,延长血液循环时间。实验表明成功合成了GSH降解中空介孔有机硅纳米胶囊和PEG化PEI功能化BSA封阻的HMONs(HMONs@HCPT-BSA-PEI-CDM-PEG)。 图1 2. 响应GSH的药物释放和纳米颗粒吞噬 由于实体瘤的这种异常代谢,肿瘤细胞内会积累高剂量的还原性谷胱甘肽。基于实体肿瘤的特点,设计了一个纳米药物和siRNA传递系统,其具有弱酸性和GSH响应性(HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4)。HCPT释放结果表明(图2A),纳米平台具有良好的GSH响应能力。采用流式细胞术(FCM)(图2B)和激光共聚焦扫描显微镜(CLSM)(图2C,D)对纳米颗粒的吞噬作用进行表征。由于CDM键的断裂,暴露PEI可以增强B16F10的细胞摄取功效。PEG-CDM组对肿瘤微环境的弱酸反应并暴露PEI组。B16F10细胞呈现强正电荷促进吞噬作用,这与其他研究一致。在肿瘤细胞中,纳米药物和siRNA传递系统持续释放化疗药物HCPT和siMCT-4,用于协同肿瘤化疗免疫治疗。 通过琼脂糖凝胶阻滞试验验证纳米颗粒负载siRNA的效果。结果表明,当纳米颗粒与siRNA的重量比(w:w)为10:1时,siRNA可以完全负载。最终的重量比为20:1,以供进一步研究。通过免疫荧光(图2E)和Western blotting实验(图2F)验证了负载siMCT-4的纳米颗粒对B16F10细胞中MCT-4表达的影响。结果表明,与其他组相比,负载siMCT-4的纳米颗粒能有效抑制MCT-4的表达。 图2 3.乳酸对体外巨噬细胞极化的影响 通过RAW264.7细胞与肿瘤细胞(B16F10细胞和4T1细胞)共培养实验,验证乳酸对体外巨噬细胞表型极化的影响(图3A)。Western blotting检测结果表明,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4显著沉默了B16F10细胞和4T1细胞中MCT-4的表达(图3B)。经HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4处理后,共培养液(RAW264.7细胞与B16F10细胞共培养)中的细胞外乳酸含量较其他处理低(图3C)。同时,B16F10细胞的胞内乳酸含量高于其他处理(图3D)。以上结果与RAW264.7细胞与4T1细胞共培养模型的结果高度一致。上述实验结果证明,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4可以抑制MCT-4的表达,并进一步抑制B16F10细胞和4T1细胞的乳酸外流。 图3 流式细胞仪检测M1型标记物CD86和M2型标记物CD206的表达。结果提示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组M1型巨噬细胞比例明显增加。HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4+forskolin组CD86表达下调,CD206表达上调。HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4+乳酸组也表现出与HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组相反的趋势,说明培养基中的乳酸在巨噬细胞表型极化中起着重要作用。此外,与仅用DMEM培养基组相比,B16F10或4T1细胞共培养组中CD86和CD206的表达略有上调(图3E,F)。采用免疫荧光法检测不同处理后CD86和CD206的表达情况。从CLSM图像中可以看到HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组CD86表达明显增加,CD206表达明显减少(图3G,H)。其他组的结果及相关荧光定量统计(图3I,J)与FCM检测结果趋势一致。以上结果表明,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4在体外通过抑制乳酸外流显著诱导RAW264.7细胞表型向M1型极化。 4.纳米平台的细胞活力和细胞毒性评价 本研究中,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4在体外可显著抑制B16F10和4T1细胞活力,诱导肿瘤细胞凋亡。Western blotting检测不同处理后细胞凋亡相关蛋白的表达。WB结果显示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4+Forskolin和HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4组显著诱导B16F10细胞和4T1细胞中Bax的表达,但Bcl-2的表达受到抑制(图4A),蛋白灰度定量统计结果一致(图4B)。结果显示,两组均具有较高的细胞毒性,可显著诱导肿瘤细胞凋亡。与其他组相比,也显著抑制了B16F10和4T1细胞活力(图4C)。为了进一步研究负载HCPT和siMCT-4的纳米平台的细胞毒性,作者使用Annexin V-FITC/PI细胞凋亡试剂盒确认不同处理后的细胞毒性(图4D)。流式细胞术检测结果提示两组均能诱导肿瘤细胞凋亡,且有时间依赖性。HMONs-BSA-PEI-CDM-PEG具有轻微的细胞毒性。 图4 5.利用纳米平台通过抑制肿瘤细胞内乳酸外流激活巨噬细胞M2到M1极化和恢复体内T细胞活性 为了验证MCT-4在体内沉默的有效性,我们在各种治疗后处死B16F10或4T1荷瘤Balb/c小鼠。对B16F10肿瘤组织(图5A)和4T1肿瘤组织(图5H)进行Western blotting检测MCT-4的表达。结果显示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4+Forskolin和HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组抑制了MCT-4的表达。此外,通过检测肿瘤组织细胞中乳酸含量和TME中乳酸含量,证明通过抑制乳酸在体内的外流,肿瘤细胞中乳酸含量增加,TEM中乳酸含量降低。从相关结果(图5C,D,I,J)中,作者发现HMONs@HCPT-BSA-PEI-CDM@siMCT-4+Forskolin和HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组显著抑制了B16F10和4T1荷瘤小鼠的乳酸外流量。 图5 接下来作者研究了抑制乳酸外流对TAM表型极化和恢复体内CD8+T细胞活性的影响,结果表明HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组明显降低了M2型TAMs的百分比(图5D,F,K,M),同时增加了M1型TAMs的能力(图5E,F,L,M)。免疫荧光法检测B16F10肿瘤组织中TAM标记物(CD11b)、M2型标记物(CD206)和M1型标记物(CD86)的表达。HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组抑制了CD206的表达,诱导了CD86的表达,这与B16F10肿瘤组织的FCM检测结果一致。检测了B16F10或4T1肿瘤组织中Treg细胞的百分比,验证了工程化的纳米平台清除免疫抑制TME的效率。以上结果证实HMONs@HCPT-BSA-PEICDM-PEG@siMCT-4在体内通过抑制乳酸外流的作用,有效地将TAMs的表型从M2型极化为M1型,降低Treg细胞的百分比,恢复CD8+T细胞的活性。 6.体内对肿瘤组织免疫应答的恢复及对肺肿瘤转移的抑制 进一步讨论抑制乳酸外流在免疫抑制TME和激活体内免疫应答中的作用,相关结果表明,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组的相关免疫细胞比例明显高于其他组(图6A,B),证明HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4在体内通过抑制乳酸外流,显著缓解免疫抑制TME,激活免疫应答。采用免疫荧光法检测B16F10肿瘤组织中的免疫促进因子(IFNγ、TNF-α)和免疫抑制因子(Arg1、TGF-β),分析其抗肿瘤作用机制。根据CLSM图像,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组显著诱导免疫促进因子表达(图6B),降低免疫抑制因子表达(图6D)。对应的荧光定量统计(图6H)与FCM和IF检测结果趋势一致。上述结果表明,在免疫抑制TME中,乳酸是主要的免疫调节因子。通过抑制乳酸外流可以有效地将免疫抑制型肿瘤转化为“热”型肿瘤,在体内实现免疫应答。 图6 有研究表明,免疫抑制TME中乳酸含量与肿瘤细胞肺转移密切相关。有报道使用Balb/c小鼠肺转移模型来证明HMONs@HCPT-BSA-PEICDM-PEG@siMCT-4对B16F10细胞和4T1细胞肺转移的影响(图6C)。经不同处理后,肺组织图像显示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组明显抑制肺转移,减少了B16F10细胞(图6D,E)和4T1细胞(图6F,G)肺转移结节的形成。此外,H&E染色结果还显示HMONs@HCPT-BSAPEI-CDM-PEG@siMCT-4组B16F10细胞和4T1细胞通过抑制乳酸外流转移到肺组织。 7.体内抗肿瘤效能 利用B16F10和4T1荷瘤小鼠研究HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4在体内的抗肿瘤效能(图7A)。从图7B的荷瘤图像来看,HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组与其他组相比,肿瘤生长明显受到抑制。相关肿瘤体积(V/V0)结果(图7C)与荷瘤小鼠图像趋势一致。肿瘤组织重量结果显示HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4组体内抗肿瘤效果最好(图7D)。进一步研究体内肿瘤细胞的凋亡情况,图7E和F证实HMONs@HCPT-BSAPEI-CDM-PEG@siMCT-4组明显诱导体内肿瘤细胞凋亡。相关的荷瘤生存率结果表明HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4具有显著的抗肿瘤效果,并显著延长荷瘤小鼠的生存时间。 接下来揭示了HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4对Balb/c小鼠的生物相容性和细胞毒性,荷瘤小鼠的体重证明HMONs@HCPT-BSA-PEI-CDM-PEG@siMCT-4在体内具有良好的生物相容性。此外,HE染色图像显示HMONs@HCPT-BSAPEI-CDM-PEG@siMCT-4对主要脏器无毒副作用,而HCPT组肝脏毒性较轻,这与其他研究一致。 为了研究停止治疗21天后肿瘤的复发,给4T1荷瘤小鼠用药。从图7E中4T1荷瘤小鼠的图像来看,与其他组相比,HMONs@HCPT-BSA-PEICDM-PEG@siMCT-4组能显著抑制肿瘤生长。相关肿瘤体积(V/V0)结果(图7F)与荷瘤小鼠图像趋势一致。肿瘤组织重量结果显示,HMONs@ HCPT-BSA-PEI-CDM-PEG@siMCT-4组抗肿瘤效果优于其他组(图7G)。相关的肿瘤体积(V / V0)证明了HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4组在停止治疗后激活了免疫反应而显著抑制肿瘤复发。从这些结果来看,HMONs@HCPT-BSAPEI-CDM-PEG@siMCT-4在体内表现出良好的抗肿瘤效果,明显延长荷瘤小鼠的生存时间,并有效抑制肿瘤复发。 图7 结 论 在本研究中,作者构建了一种纳米药物和siRNA传递系统,用于消除免疫抑制TME,抑制肿瘤生长,减少肿瘤细胞在体内的肺转移。HMONs@HCPT-BSA-PEI-CDMPEG@siMCT-4纳米平台可显著抑制MCT-4的表达并抑制乳酸外流。与此同时,纳米药物和siRNA系统通过体外抑制乳酸外流,显著诱导RAW264.7表型向M1型极化。此外,纳米平台显著消除免疫抑制的TME,将TAMs表型极化为M1型,恢复体内CD8+T细胞的活性。此外,它还能显著激活免疫应答,增强肿瘤组织中免疫促进细胞的浸润,诱导肿瘤细胞凋亡,抑制肿瘤细胞的肺转移。综上所述,级联响应性纳米平台可通过抑制乳酸外流和HCPT来调节免疫抑制的TME,从而增强肿瘤化疗免疫治疗。 索莱宝产品亮点 相关产品 产品名称 产品货号 Anti-SLC16A4 Polyclonal Antibody Anti-SLC16A3 Polyclonal Antibody Anti-CD86 Polyclonal Antibody Anti-CD206 Polyclonal Antibody Anti-MRC1 Polyclonal Antibody Anti-BAX Polyclonal Antibody Anti-BCL2 Polyclonal Antibody Anti-BCL2 Monoclonal Antibody Anti-Phospho-BCL2-S70 Polyclonal Antibody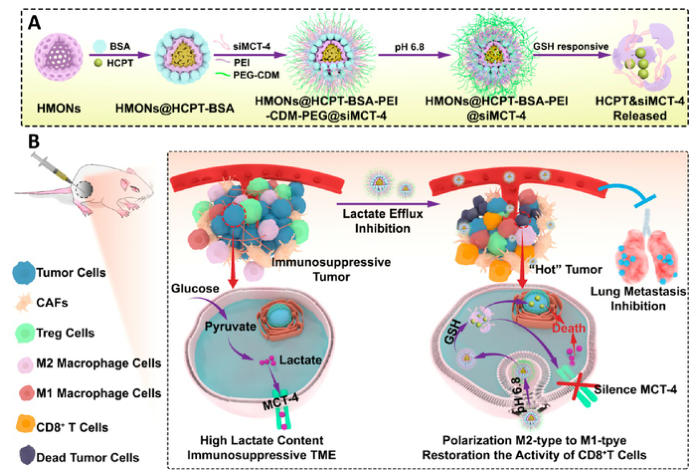




文献解读|级联响应型纳米平台抑制乳酸外流增强肿瘤化学免疫治疗
作者:北京索莱宝科技有限公司 2021-01-22T10:20 (访问量:6816)
北京索莱宝科技有限公司 商家主页
地 址: 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号85A三层
联系人: 索莱宝-龚思雨
电 话: 010-50973130
传 真:
Email:3193328036@qq.com
相关咨询
携手同行,共赢未来|索莱宝20周年经销商大会暨品牌发布会圆满落幕! (2024-12-12T00:00 浏览数:3218)
喜报|热烈祝贺北京索莱宝科技有限公司荣获“北京市质量管理工作先进集体” (2024-12-12T00:00 浏览数:3188)
花香蝶自来|Solarbio小分子化合物“优秀员工展”第十五期 (2024-12-12T00:00 浏览数:3108)
自噬体标志物 (2024-12-12T00:00 浏览数:2350)
文献简报|一种用于增强癌症免疫治疗的极简型病原体样糖纳米疫苗 (2024-12-12T00:00 浏览数:3179)
官宣|索莱宝第五届病理杯美图创意大赛结果公布 (2024-12-09T00:00 浏览数:3983)
喜讯|热烈庆贺索莱宝荣获“科学技术协会”授牌 (2024-12-09T00:00 浏览数:5850)
FAQ|Solarbio 同位素标记物 (2024-12-09T00:00 浏览数:5357)
10月文献回顾索莱宝产品护航科研之旅 (2024-12-09T00:00 浏览数:5575)
白细胞介素之抗炎细胞因子 (2024-12-09T00:00 浏览数:5379)
