代谢重编程作为癌症的一个显著特征,体现在肿瘤对营养物质利用方式的改变上,这种变化有助于其无节制地生长和存活。过去几十年,癌症代谢研究主要聚焦于葡萄糖,特别是著名的Warburg效应,即癌细胞即便在有氧条件下也倾向于将葡萄糖转化为乳酸。但近年来,研究焦点开始转向另一种糖类——果糖,发现癌细胞能够利用果糖代谢来加速肿瘤的形成和发展。
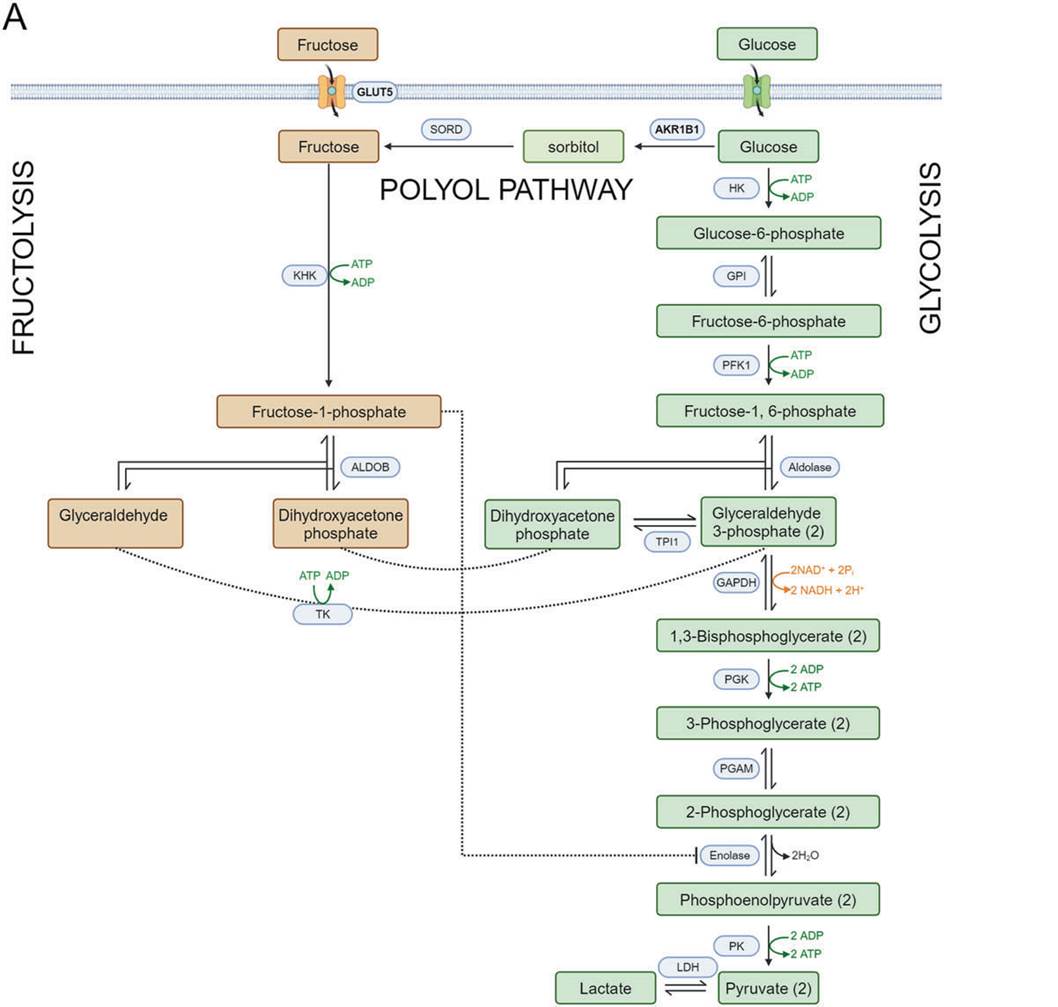
果糖常见于水果、蜂蜜及多种加工食品,尤其是含有高果糖玉米糖浆的饮料中,它在肝脏中经历一种与葡萄糖代谢不同的代谢过程。与葡萄糖代谢受胰岛素紧密调控不同,果糖的代谢相对独立,遵循果糖分解这一特定路径。在这一路径中,果糖首先通过特定的转运蛋白GLUT5进入细胞,随后迅速被果糖激酶磷酸化生成果糖-1-磷酸,再由醛缩酶B将其分解为与葡萄糖代谢中间产物相同的物质,这些物质最终参与脂质合成和能量生成。除了从食物中直接获取,果糖还可以通过多元醇途径由葡萄糖内源性转化而来,这一途径起始于醛糖还原酶(由AKR1B1基因编码),它将葡萄糖还原为山梨醇,山梨醇再由山梨糖醇脱氢酶转化为果糖,这些内源性产生的果糖可进一步参与多种细胞过程。在正常生理条件下,多元醇途径的代谢作用较为次要,但在高糖环境,如糖尿病或癌症状态下,其活性显著增强。因此,通过直接摄入果糖和激活多元醇途径的双重糖分来源,使得某些癌症对传统仅针对葡萄糖代谢的治疗方法产生了高度的耐药性[1]。因而另辟蹊径——靶向果糖代谢途径有望成为有潜力的肿瘤治疗新途径。
图1. 果糖的分解与合成
2024年10月15日,Cell Death & Differentiation(IF=13.7)同期发表了贾伟院士等团队关于果糖在癌症中的代谢机制研究文章,分别为Exploring Fructose Metabolism as a Potential Therapeutic Approach for Pancreatic Cancer和AKR1B1-dependent fructose metabolism enhances malignancy of cancer cells(麦特绘谱提供Q300全定量代谢组学和代谢流技术检测服务),详细阐述了果糖代谢在胰腺癌、肺癌等癌症中的关键作用机制,为靶向果糖代谢治疗相关癌症提供了新的见解,下面就和小编一起仔细学习这两篇精彩文章吧!
01
Exploring fructose metabolism as a potential therapeutic approach for pancreatic cancer
研究简介
胰腺癌细胞具有很高的利用果糖的能力,除了通过果糖转运体GLUT5摄取外,还能够通过AKR1B1介导的多元醇途径将葡萄糖转化为果糖。果糖代谢通过促进糖酵解和加速调节血管生成的关键代谢物的产生而加剧胰腺癌的增殖。果糖代谢的药物阻断已被证明可以减缓胰腺癌的进展,并在与抗血管生成药物联合使用时协同增强抗肿瘤能力。
研究思路
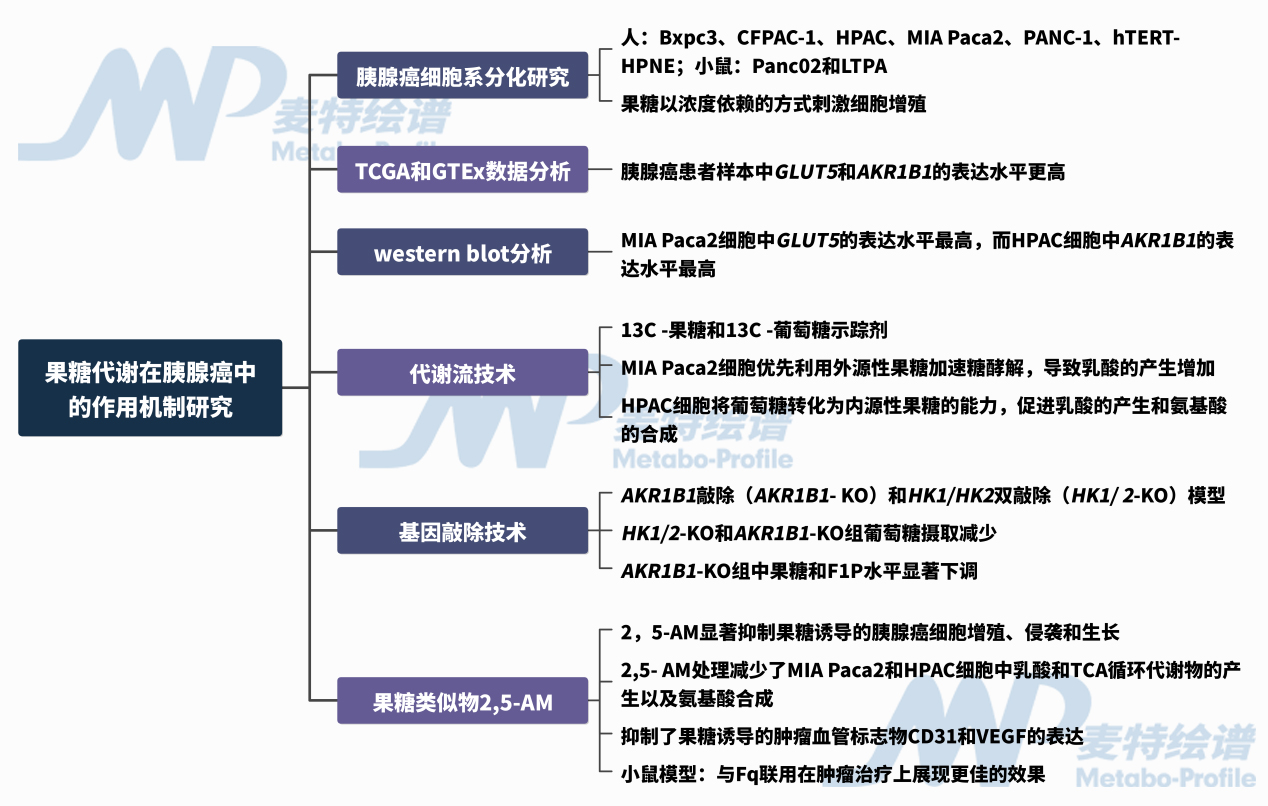
图2. 技术路线
研究结果
1. 果糖会加剧胰腺癌的生长和发展
使用多种人和小鼠胰腺癌细胞系(人:Bxpc3、CFPAC-1、HPAC、MIA Paca2、PANC-1、hTERT-HPNE;小鼠:Panc02和LTPA)进行分化程度研究,发现果糖以浓度依赖的方式刺激细胞增殖;TCGA和GTEx数据库表明胰腺癌患者样本中GLUT5和AKR1B1的表达水平更高;western blot分析表明,MIA Paca2细胞中GLUT5的表达水平最高,而HPAC细胞中AKR1B1的表达水平最高。
2. 果糖增强胰腺癌细胞的代谢活性
为进一步研究胰腺癌细胞中果糖和葡萄糖的代谢差异,使用13C-果糖和13C-葡萄糖作为示踪剂,发现MIA Paca2细胞优先利用外源性果糖加速糖酵解,导致乳酸的产生增加,而HPAC细胞具有将葡萄糖转化为内源性果糖的能力,促进乳酸的产生和氨基酸的合成。
3. 抑制果糖代谢可抑制胰腺癌的生长
通过果糖类似物2,5-AM处理胰腺癌细胞,发现其显著抑制果糖诱导的胰腺癌细胞增殖、侵袭和生长。此外,同位素示踪结果也显示了2,5- AM处理减少了MIA Paca2和HPAC细胞中乳酸和TCA循环代谢物的产生以及氨基酸(丝氨酸、谷氨酰胺、甘氨酸和谷氨酸)的合成。在小鼠模型中也表征了2,5-AM治疗可有效缓解果糖导致的肿瘤生长,并与血管生成抑制剂呋喹替尼 (furoquintinib, Fq) 组合在减弱果糖诱导的肿瘤发展方面表现出更佳的疗效。
4. 果糖代谢是胰腺癌血管生成的关键调节因子
2,5-AM有效抑制了果糖诱导的肿瘤血管标志物CD31和VEGF的表达,并且当与Fq联合使用时,这种抑制作用进一步增强。
5. 抑制果糖代谢可减缓胰腺癌的生长和血管生成
使用同位素示踪剂13C-葡萄糖处理HPAC和MIA Paca2细胞,发现标记果糖约占标记葡萄糖的一半。利用CRISPR-Cas9技术在HPAC细胞中构建了AKR1B1敲除(AKR1B1-KO)和HK1/HK2双敲除(HK1/2-KO)模型,HK1/2-KO和AKR1B1-KO组葡萄糖摄取减少, G6P水平在HK1/2-KO组显著降低,表明葡萄糖代谢受到抑制,AKR1B1-KO组中果糖和F1P水平显著下调,表明多元醇途径受到抑制,进一步证实了胰腺癌细胞可以利用葡萄糖转化产生的内源性果糖加速糖酵解和氨基酸合成,为癌细胞生长提供能量和生物量。
小结
本研究表明胰腺癌细胞通过GLUT5摄取果糖和多元醇途径转化内源性果糖,加速糖酵解和代谢物的产生,从而促进肿瘤生长和血管生成,2,5-AM与呋喹替尼联合使用发现可以有效减缓肿瘤生长和血管生成,强调了靶向果糖代谢作为调节胰腺癌肿瘤生长和血管生成的潜在治疗策略的重要性。
原文信息
Exploring fructose metabolism as a potential therapeutic approach for pancreatic cancer. Cell Death & Differentiation. 2024.
请扫描二维码阅读原文
02
AKR1B1-dependent fructose metabolism enhances malignancy of cancer cells
研究简介
果糖代谢已成为癌细胞增殖的重要因素,但果糖对癌细胞的潜在机制和来源仍不完全清楚,本研究旨在探讨癌细胞产生内源性果糖的分子机制,以及这类果糖在代谢稳态和肿瘤中的作用。
研究思路
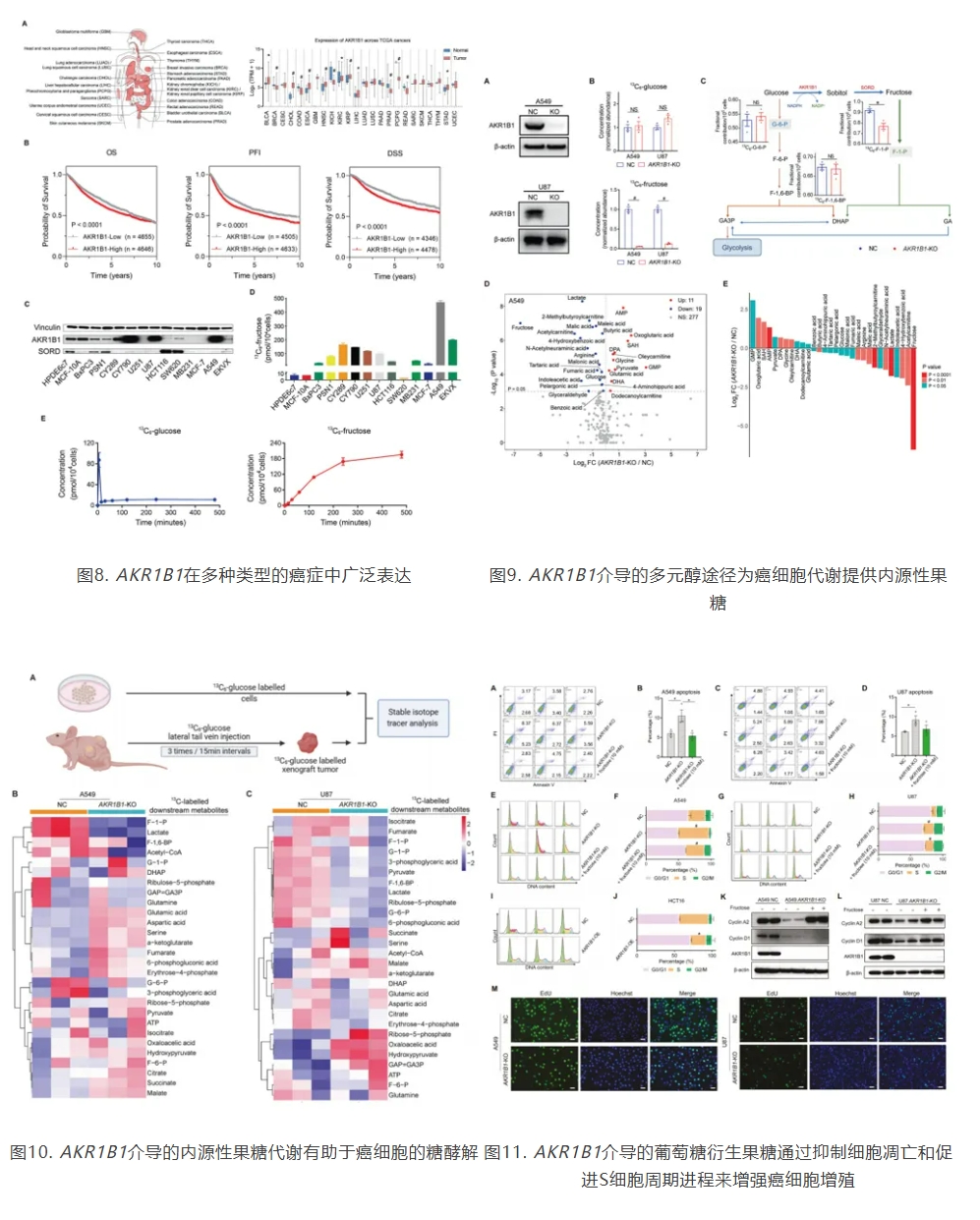
图7. 技术路线
研究结果
1. AKR1B1酶(醛基酮还原酶家族1成员B1)在多种癌症中高表达,通过多元醇途径将葡萄糖转化为果糖,与癌症预后不良相关。阻断AKR1B1能减少癌细胞内果糖产生,影响乳酸合成及Warburg效应等代谢途径,表明内源性果糖对癌细胞代谢至关重要。
2. AKR1B1基因敲除的癌细胞(A549和U87)在低浓度葡萄糖条件下乳酸产量有限,而对照组细胞则能随着葡萄糖水平升高持续产生乳酸。通过采用13C-果糖同位素示踪技术,研究证实了癌细胞能够利用外源性果糖产生如乳酸等下游代谢产物。
3. A549和U87细胞中敲除AKR1B1或使用其抑制剂显著抑制细胞增殖和集落形成,而外源性果糖补充可恢复AKR1B1缺失导致的癌细胞生长障碍,在AKR1B1低表达的HCT116和BxPC3细胞中过表达该基因则促进细胞生长。体内实验也证实,AKR1B1敲除显著减缓A549和U87细胞异种移植瘤的生长,表明AKR1B1介导的多元醇途径中葡萄糖衍生果糖的生产和代谢对癌细胞体内生长至关重要。
4. 阻断癌细胞中葡萄糖向果糖的转化(通过敲除AKR1B1或使用抑制剂)会增加细胞凋亡,导致S期细胞周期阻滞,并降低细胞周期进展标志物(如cyclin A2和cyclin D1)的表达。外源性果糖补充可逆转这些效应。此外,AKR1B1敲除显著抑制了DNA复制,这可能是导致S期阻滞的原因。
5.AKR1B1介导的果糖生成影响癌细胞迁移能力,其缺失会抑制癌细胞迁移,而外源性果糖补充可逆转此效应。AKR1B1还通过激活RhoA-ROCK2通路促进肿瘤转移,且该通路在单细胞转移模式中起主要作用。
小结
癌细胞利用多元醇途径产生果糖,从而获得比同等量的葡萄糖更多的能量和生物量。癌细胞中的果糖代谢导致乳酸和生物质代谢中间产物增加,对Warburge效应有显著贡献。此外,AKR1B1介导的内源性果糖代谢通过细胞周期蛋白和RhoA-ROCK2信号通路调节细胞增殖和阿米巴样迁移,最终增加肿瘤的恶性程度。这些发现表明AKR1B1是一个有潜力的治疗靶点。
原文信息
AKR1B1-dependent fructose metabolism enhances malignancy of cancer cells. Cell Death & Differentiation. 2024.
请扫描二维码阅读原文
总结
这两项研究共同揭示了多元醇-果糖代谢途径在促进Warburg效应和癌症进展中的关键作用,从不同的切入角度和研究方式明确了果糖代谢与多种癌症之间的联系,强调了果糖代谢作为抗肿瘤治疗靶点的重要性。
参考文献
1. Frezza C. Fructose: the sweet(er) side of the Warburg effect. Cell Death Differ. 2024;31(11):1395-1397. doi:10.1038/s41418-024-01395-2
绘谱帮你测
贾老师团队两篇论文全面描绘了果糖促肿瘤的有趣新知,果糖作为能量代谢过程中的重要角色,需要合理控制果糖的摄入量,以维持能量代谢平衡和健康。其实除癌症研究外,果糖还与脂质稳态、葡萄糖代谢稳态、食欲和肥胖、高血压等密切相关。在上述研究中,靶向-全定量代谢组学可对生物样品中小分子代谢物进行全面、系统的分析,可以灵敏捕捉到机体代谢的细微变化,是寻找疾病生物标志物或药物靶标的有力工具,而代谢流技术利用13C-果糖、13C-葡萄糖同位素示踪剂进行下游代谢产物的分析,推算其分布规律和流向。
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。