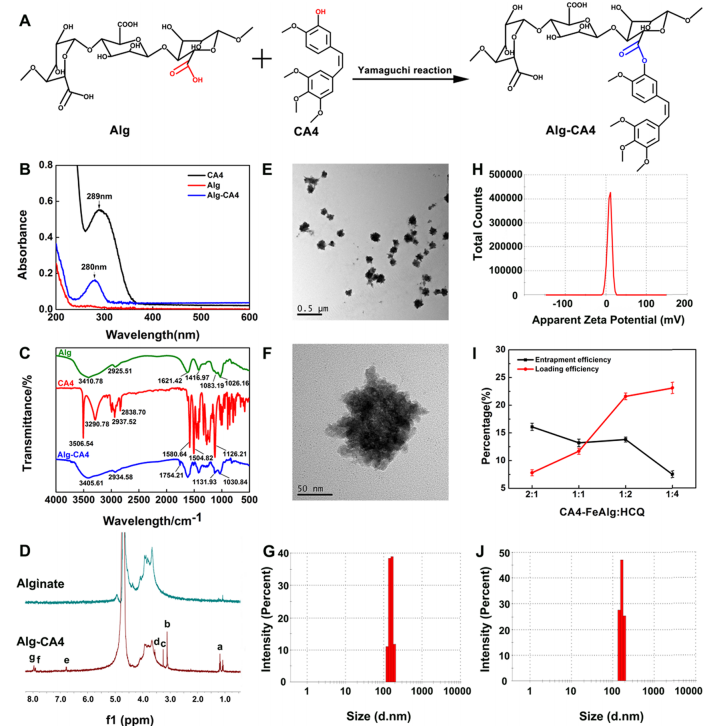
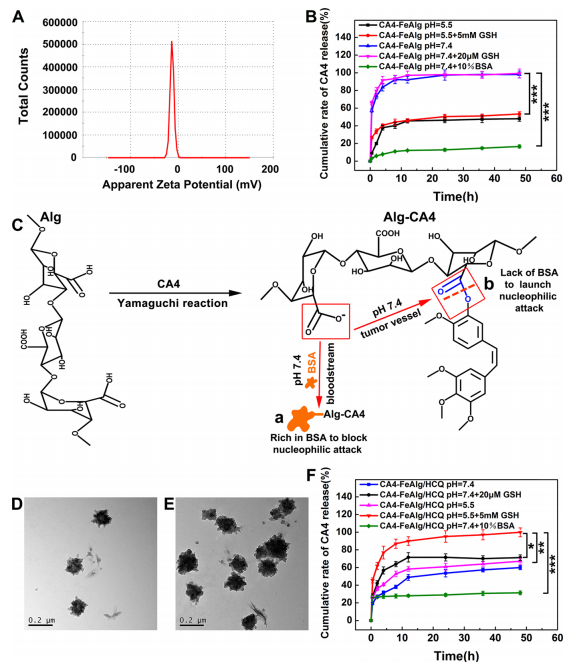
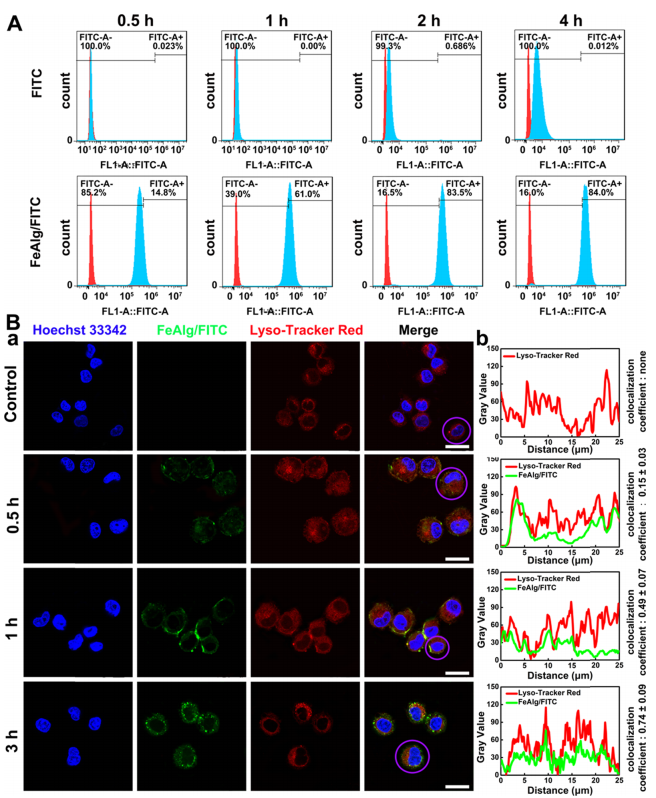
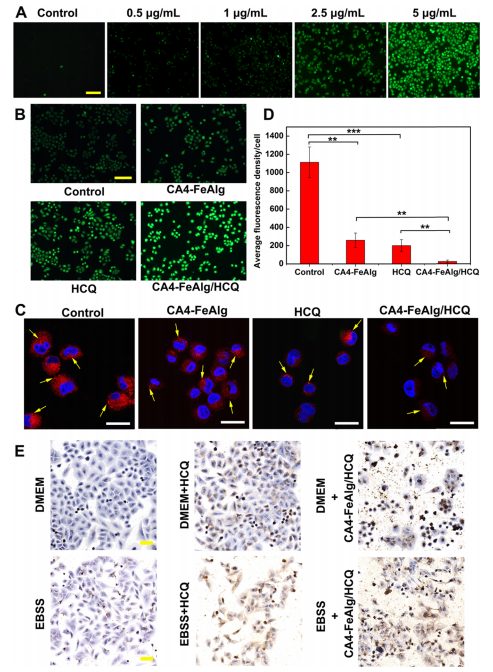
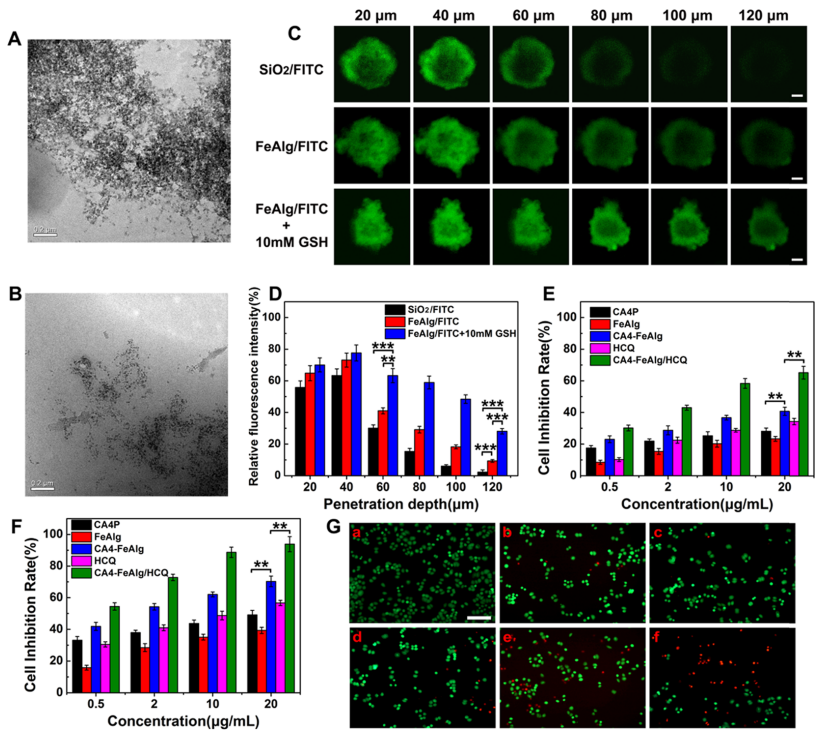
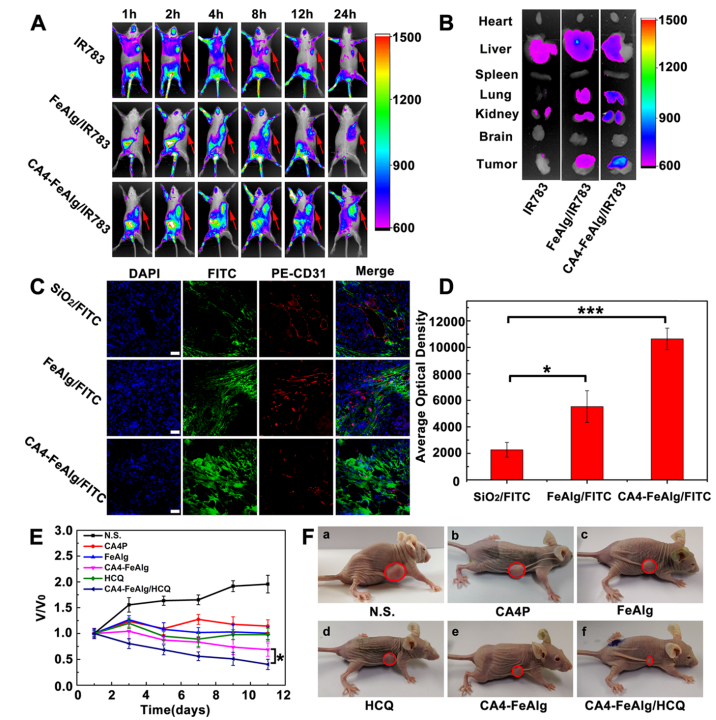
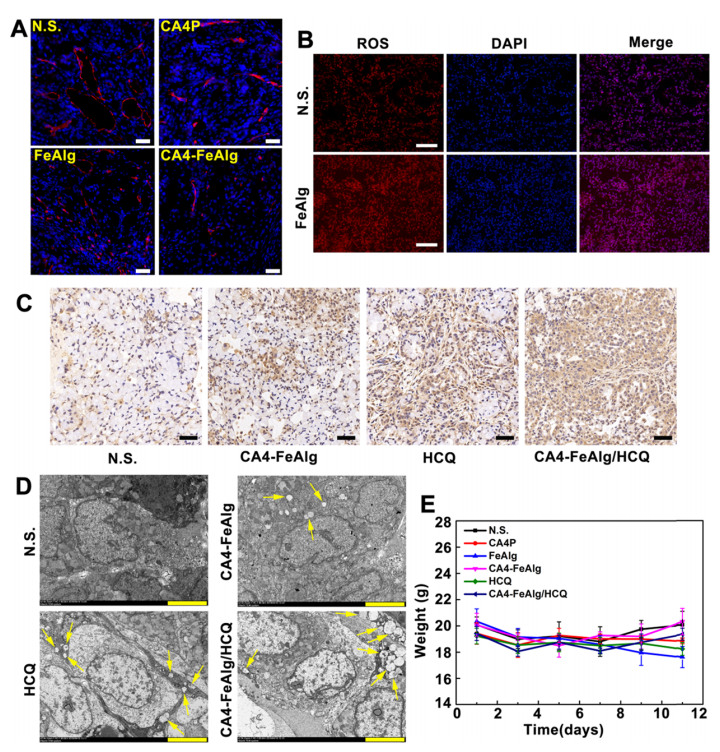
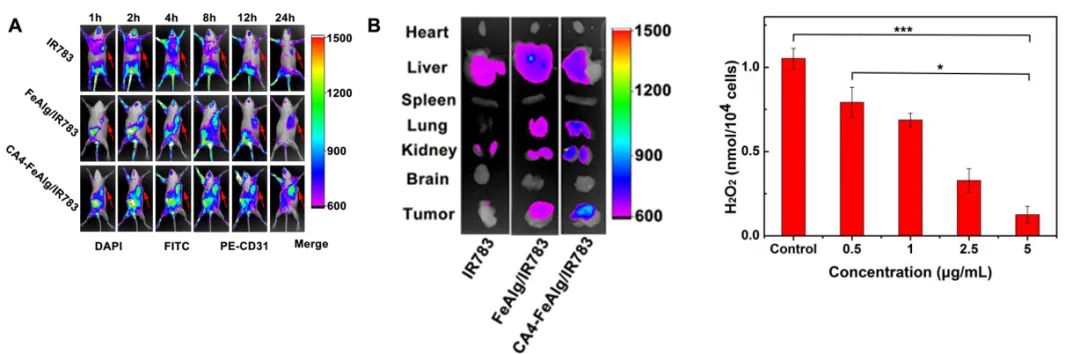
肿瘤是一种复杂难治的疾病,对人类健康存在重大威胁。当肿瘤体积超过2-3mm3时,肿瘤的增殖、转移与扩散主要依靠自身的血管系统来提供必要的氧气和营养物质。而在缺乏血管的情况下,肿瘤具有自限性生长的特点。因此,将肿瘤血管作为靶点,抑制它的形成或破坏其存在,直接切断肿瘤增殖与转移的营养通道,是一个有吸引力的治疗策略。 目前,根据作用机制的不同,血管靶向药物(VTAs)主要包括两大类:血管生成抑制剂(AIs)和血管阻断剂(VDAs)。在VDAs中,康普瑞汀(CA4)作为最常用的小分子血管阻断剂,具有良好的抗血管活性,但其水溶性较差,难以通过血管给药。所以,利用纳米技术开发合适的递药体系可以有效改善CA4小分子药物的缺陷,为其临床应用提供一个新策略。 纳米凝胶具有良好的水分散性、优异的生理稳定性和结构可塑性。其中常作为药用辅料的海藻酸钠(Alg)因具有良好的生物相容性、可生物降解、廉价无毒以及易于凝胶化等优点受到极大的关注。研究发现,Alg可以通过与多种过渡金属阳离子交联形成“蛋-盒”型螺旋水凝胶。Fe3+可与Alg交联形成稳定的水凝胶,但当Fe3+经可见光或抗坏血酸等光电化学还原为Fe2+后,Fe2+与Alg的交联能力迅速减弱,导致水凝胶自外而内进行解离,然后溶解。肿瘤微环境(TME)可作为铁离子发生氧化态转换的诱导剂,实现药物在肿瘤的定点释放。 基于上述背景,郑州大学药物研究院张慧娟课题组首次设计了一种定位重塑型纳米凝胶CA4-FeAlg/HCQ。在CA4-FeAlg/HCQ纳米凝胶到达肿瘤部位后,首先在肿瘤血管释放CA4,阻断外源性营养和氧气供应,导致肿瘤细胞坏死。随后FeAlg/HCQ分解成小纳米粒穿透到肿瘤组织深部,Fe3+在低pH、高GSH条件下还原为Fe2+,纳米凝胶自外而内快速解离,HCQ持续释放。此外,Fe2+可与瘤内H2O2发生芬顿反应,产生强细胞毒性的•OH,进一步增强抗肿瘤作用。该研究为利用纳米载体系统提高瘤内药物递送效率提供了一种有效的递送策略,并为增强抗肿瘤免疫应答提高肿瘤治疗效果提供了一种有意义的探索。 图1 基本信息 题目: Positioning Remodeling Nanogels Mediated Codelivery of Antivascular Drug and Autophagy Inhibitor for Cooperative Tumor Therapy 期刊:ACS Applied Materials & Interfaces 影响因子:8.758 PMID: 31951366 第一作者:张红岭副教授 通讯作者:张慧娟教授 作者单位:郑州大学药物研究院 索莱宝合作产品: 产品名称 产品货号 Combretastatin A4 康普瑞汀 Earle's Balanced Salt Solution EBSS The micro H2O2 assay kit 过氧化氢(H2O2)含量检测试剂盒 摘 要 肿瘤血管系统和增强的自噬共同为肿瘤的生长、增殖与转移供应营养物质。阻断外界营养供给,实现肿瘤饥饿治疗,将是一种有前途的抗肿瘤方法。本研究中,作者构建了一种具有定位重塑功能的智能纳米凝胶CA4-FeAlg/HCQ,可以全方位精确杀死A549癌细胞。CA4-FeAlg/HCQ纳米凝胶在血液循环中稳定存在,当它们到达肿瘤血管环境时,首先释放血管阻断剂康普瑞汀(CA4),发挥抗血管作用。此后,FeAlg/HCQ解体为小纳米凝胶(<30nm),有利于向肿瘤组织的深部渗透。进入肿瘤细胞后,FeAlg/HCQ纳米凝胶将发生相重构(凝胶→溶胶),从而快速释放出自噬抑制剂羟氯喹(HCQ)。CA4-FeAlg纳米凝胶诱导的自噬可被HCQ有效抑制,从而实现抗血管与自噬抑制协同治疗肿瘤的目的。活性氧结果显示,在肿瘤微环境下,FeAlg中的Fe3+还原为Fe2+后,可以通过芬顿反应有效产生•OH,进一步杀死肿瘤细胞。药效学实验显示,CA4-FeAlg/HCQ的体内治疗效果最佳,相对肿瘤体积最终可下降至0.40±0.10。本研究将为药物的共递送和联合应用提供一个有前景的策略。 研究结果 1.CA4-FeAlg/HCQ纳米颗粒的制备与表征 CA4-FeAlg/HCQ的制备过程如图1A所示。按图2A步骤合成Alg-CA4偶联物,图2B表明CA4成功连接到Alg分子上。CA4是通过新的酯键合成,成功接至Alg骨架上(图2C)。制备的Alg-CA4可通过核磁共振氢谱进一步研究其化学结构(图2D)。TEM直观显示CA4-FeAlg纳米凝胶的形态为类球形,尺寸分布相对均匀(图2E、F)。CA4-FeAlg平均水合粒径约为150nm(图2G)。以Fe3+为交联剂合成的CA4-FeAlg平均电位值从-21.9mV变为9.23mV(图2H)。 选择自噬抑制剂HCQ作为联用药物协同治疗肿瘤。将CA4-FeAlg冻干粉在HCQ溶液中缓慢溶胀,更多的HCQ分子随着水分子进入纳米凝胶网络中。如图2I所示,投药比为1:2是最优制备条件。CA4-FeAlg/HCQ纳米凝胶的粒径分布范围依然较窄,最终水合粒径为165nm(图2J)。在进一步载药后,CA4-FeAlg/HCQ的平均电位值也由9.23mV变为-13.1mV(图3A)。 图2 2.药物释放能力的评估 研究者采用pH7.4+10%BSA溶液模拟血液生理环境。在这种介质溶液中,48h内只有17%的CA4从CA4-FeAlg中释放出来(图3B)。此外由释放曲线可知,CA4的释放具有pH依赖性(图3B)。与在pH5.5介质溶液中相比,置于pH7.4介质溶液中(模拟肿瘤血管环境)的CA4释放速率更快,其累积释药百分率在12h内甚至达到92.12%(图3C)。CA4释放后的纳米凝胶仍保留原始结构(图3D),与直接合成的FeAlg结构并无明显差异(图3E)。这一结果说明,CA4-FeAlg纳米凝胶在血液循环过程中可以稳定存在,而在肿瘤血管处CA4可以快速释放出来。 接下来,用同样的方法评估了HCQ在CA4-FeAlg/HCQ体系中的释放特性(图3F)。从图3F可以看出,HCQ在有GSH存在的介质中释放速度明显加快。这一现象归因于在GSH的还原条件下,纳米凝胶中的Fe3+被还原为Fe2+,Fe2+与Alg的亲和作用降低,纳米凝胶自外而内进行解离,从而实现HCQ的有效释放。在弱酸性环境中(pH5.5+5mM GSH,模拟肿瘤细胞)这种现象表现更明显,24h时HCQ的累积释药率可达到95.07%,而pH7.4+10%BSA介质中HCQ释放较慢。以上结果表明,CA4-FeAlg/HCQ递药体系在血液和正常组织中能够保持相对稳定,而蓄积到肿瘤部位后CA4和HCQ可在各个靶向位点连续释放。 图3 3.细胞摄取和溶酶体共定位 如图4A所示,FeAlg纳米凝胶可被A549细胞高效摄取,实现药物的有效递送。为了进一步探索FeAlg在细胞内的分布,利用LSCM对纳米凝胶与细胞器的共定位现象进行了可视化研究。如图4B所示,由于游离FITC无法进入A549细胞,视野中未发现绿色荧光,FeAlg/FITC组在共孵育0.5h时,胞质内首先观测到微弱的绿色荧光,荧光灰度值显示FeAlg与溶酶体的平均共定位系数为0.15±0.03。随着培养时间的推移,细胞中的绿色荧光也在一直不断增多并且逐渐聚集于溶酶体,在1h和3h时,平均共定位系数分别增加到0.49±0.07和0.74±0.09。以上结果显示溶酶体可能成为FeAlg/HCQ纳米凝胶递药系统发挥抗肿瘤作用的有效靶点。 图4 4.溶酶体损伤与自噬抑制 当纳米凝胶被肿瘤细胞摄取并蓄积在溶酶体内后,Fe3+在高GSH作用下转化为Fe2+,在这种特殊的微环境中Fe2+又可与瘤内H2O2引起“芬顿”反应生成•OH(图5A),导致溶酶体破裂,从而使自噬溶酶体的形成及降解受到严重阻碍。药物处理6h后,细胞内pH变化趋势如图5B所示。与空白组相比,HCQ和CA4-FeAlg/HCQ组的荧光信号明显增强,表明细胞内pH值显著升高。 为了研究•OH和pH值变化对溶酶体稳定性的影响,用LSCM记录溶酶体的变化情况。如图5C和图5D所示,空白对照组中所有细胞的溶酶体形态完整,联合•OH和pH升高对溶酶体的破坏效应,CA4-FeAlg/HCQ处理组中平均荧光密度骤降至25.44,仅为对照组的2.28%。由此表明,FeAlg和HCQ可以共同作用于溶酶体。 接下来,作者研究了CA4-FeAlg/HCQ在缺乏营养时,对肿瘤细胞自噬水平的影响。图5E显示,与DMEM组相比,在EBSS组中出现了显著的LC3蛋白的阳性自噬体。HCQ和CA4-FeAlg/HCQ处理后,细胞内的LC3蛋白表达均显著增加。这是因为营养缺乏诱导细胞自噬后,•OH引起的溶酶体膜的不稳定和HCQ引起的溶酶体酸性环境的破坏可以协同抑制自噬小体的降解,导致大量自噬体的积累。LC3-II:LC3-I值也为证明CA4-FeAlg/HCQ通过抑制自噬引起自噬体累积提供了依据。以上结果表明,CA4-FeAlg/HCQ在无营养情况下能有效抑制肿瘤细胞自噬。 图5 5.体外肿瘤深部渗透与细胞毒性 通过体外模拟TME,研究CA4-FeAlg纳米凝胶的形态变化。在pH6.5,20μM GSH的介质中,CA4-FeAlg已经明显解体为小纳米凝胶,水合粒径减小为27nm左右(图6A)。而当酸性变强,GSH浓度增加后,CA4-FeAlg纳米凝胶自外向内解离,发生了相重构,大多数纳米凝胶的粒径变得更小甚至溶解(图6B)。这是因为FeAlg纳米凝胶的交联剂Fe3+可以被GSH迅速还原为Fe2+。Fe2+与Alg的相互作用较弱导致FeAlg结构从外向内解离。 研究者利用3DMCS模型考察体外深部渗透效果。如图6C表明SiO2纳米粒子很难扩散到肿瘤深部。而在80μm深度时,FeAlg/FITC组中有强烈的绿色荧光分布在肿瘤球的中央区域。120μm深度时,FeAlg/FITC+10mM GSH组中有更多的绿色荧光分布于肿瘤球的中央范围内,其相对荧光强度是SiO2/FITC组的12倍。图6D显示,FeAlg/FITC+10mM GSH组的相对荧光强度均高于其他两组。以上结果表明FeAlg纳米凝胶分裂成小的纳米颗粒后,利于实现肿瘤的深部渗透。 图6 CA4-FeAlg和CA4-FeAlg/HCQ的细胞毒性明显集中,呈一定的时间依赖性(图6E和F)。选择CA4前药CA4P作为阳性对照组。CA4-FeAlg组的细胞抑制率均明显高于CA4P组,表明CA4-FeAlg纳米凝胶可作为CA4前药用于肿瘤治疗。此外,如图6F所示,CA4-FeAlg/HCQ对A549细胞的毒性最强。当药物浓度为20μg/mL,作用时间为48h时,CA4-FeAlg/HCQ组的细胞抑制率甚至达到93.86±4.78%。此外,观察CA4-FeAlg/HCQ组的活细胞数(绿色)最少(图6G)。基于以上结果,CA4-FeAlg/HCQ可在体外有效杀伤A549肿瘤细胞。 6.体内肿瘤的靶向性与穿透性 如图7A所示,游离的IR783广泛分布于裸鼠体内,并在体内被迅速清除。随着时间的延长,肿瘤内的荧光信号大幅度减弱。而FeAlg/IR783和CA4-FeAlg/IR783组肿瘤区域的荧光信号都在逐渐增加,在8h时达到最高。随后,FeAlg/IR783组肿瘤内的荧光强度迅速下降,24h时仅存在微弱荧光。然而,CA4-FeAlg/IR783在24h仍有较强的荧光。体外成像结果(图7B)显示游离IR783主要在肝、肾组织内分布,FeAlg/IR783主要存在于肝组织,肾、肺和肿瘤组织中也有少量分布。CA4-FeAlg/IR783主要存在于肿瘤组织,这归因于CA4与β-微管蛋白上的秋水仙碱受体结合。以上结果进一步证明CA4-FeAlg/IR783具有优异的肿瘤靶向性,有助于药物在肿瘤部位大量蓄积。 作者研究了CA4-FeAlg/HCQ在肿瘤组织内的深部穿透性能。如图7C和7D所示,粒径稳定的SiO2/FITC肿瘤组织穿透性较差,主要分布在肿瘤血管周围。然而,FeAlg/FITC组中的穿透距离显著增大。上述结果均表明CA4-FeAlg可以将治疗药物高效递送至肿瘤部位,并均匀渗透到实体瘤组织中。 图7 7.体内抗肿瘤效果和安全性评价 为了系统性评价CA4-FeAlg/HCQ的抗癌性能,作者研究了CA4-FeAlg/HCQ在A549荷瘤裸鼠体内的抗肿瘤作用。如图7E所示,N.S.组的相对肿瘤体积一直在升高,最终达到1.96±0.17。CA4P对肿瘤生长有一定程度的抑制作用,但肿瘤体积波动较大。相比之下,CA4-FeAlg能够显著抑制A549肿瘤的生长,揭示CA4-FeAlg作为新型的CA4前药具有良好的抗肿瘤效果。CA4-FeAlg/HCQ的治疗效果最佳,治疗终点时的肿瘤体积最小(图7F)。CA4-FeAlg/HCQ的最佳抗肿瘤作用可能来源于以下三个机制:其一,CA4破坏肿瘤血管系统切断外源性营养供应,肿瘤细胞发生坏死;其二,FeAlg通过响应TEM生成ROS产生细胞毒性;其三,CA4诱导的自噬被HCQ抑制,阻断肿瘤细胞的内源性营养通道。接下来,研究者逐一验证了这些可能的机制。 如图8A所示,N.S.组中的肿瘤血管相对完整、丰富。然而,CA4P组中的肿瘤血管密度明显降低。在CA4-FeAlg组,肿瘤血管数量最少,细胞之间的空隙也变大。接下来,作者对肿瘤细胞内的•OH含量进行了测定。实验结果表明(图8B),FeAlg给药组的肿瘤细胞中•OH含量明显增加,荧光强度是N.S.组的3.58倍。由此表明,FeAlg在肿瘤细胞中可以通过芬顿反应高效快速的产生大量•OH。研究者采用免疫组化与TEM表征对CA4-FeAlg/HCQ抑制肿瘤细胞自噬的情况进行考察。如图8C所示,与N.S.和CA4-FeAlg组相比,HCQ和CA4-FeAlg/HCQ组自噬相关蛋白LC3表达明显升高,其中以CA4-FeAlg/HCQ组表达水平最高。此外,TEM结果(图8D)也证明,经CA4-FeAlg/HCQ处理后的肿瘤细胞中显著存在大量累积的自噬泡(黄色箭头指示)。这再次提示CA4-FeAlg抗血管治疗诱导的自噬可被HCQ有效抑制,从而实现抗血管与自噬抑制协同治疗肿瘤的目的。 研究者记录了治疗期间荷瘤小鼠的体重。如图8E所示,各组之间的荷瘤鼠体重没有发生急剧下降的现象,治疗期间的变化趋势基本相同,没有显著性差异,说明CA4-FeAlg/HCQ纳米凝胶相对安全,毒副作用较小。各组心、肝、脾、肺、肾、脑组织均无明显病理改变,进一步证明了CA4-FeAlg/HCQ的生物安全性。 图8 研究结论 综上所述,研究者成功构建了定位重塑型纳米凝胶(CA4-FeAlg/HCQ),用于共递送血管阻断剂CA4与自噬抑制剂HCQ,实现了CA4和HCQ在肿瘤血管和肿瘤细胞中的连续释放,以及对A549非小细胞肺癌的协同治疗。另外,FeAlg可催化瘤内H2O2产生强细胞毒性的•OH,进一步增强抗肿瘤作用。该系统将为药物的共递送和联合应用提供了一个有前景的策略。 索莱宝产品亮点 相关产品 产品名称 产品货号 Combretastatin A4 康普瑞汀 Hydroxychloroquine Sulfate 硫酸羟氯喹 Glutathione reduced 还原型谷胱甘肽 FITC 异硫*酸荧光素 Paclitaxel 紫杉醇 Docetaxel 多西他赛 Vincristine sulfate 硫酸长春新碱 Epothilone B 埃博霉素 B Trigonelline 葫芦巴碱 Nocodazole 诺考达唑 Cabazitaxel 卡巴他赛 Epothilone A 埃博霉素 A Albendazole 阿苯达唑 Vindoline 文多灵 Griseofulvin 灰黄霉素 丙二醛(MDA)含量检测试剂盒 多酚氧化酶(PPO)活性检测试剂盒 超氧阴离子含量检测试剂盒 二胺氧化酶活性检测试剂盒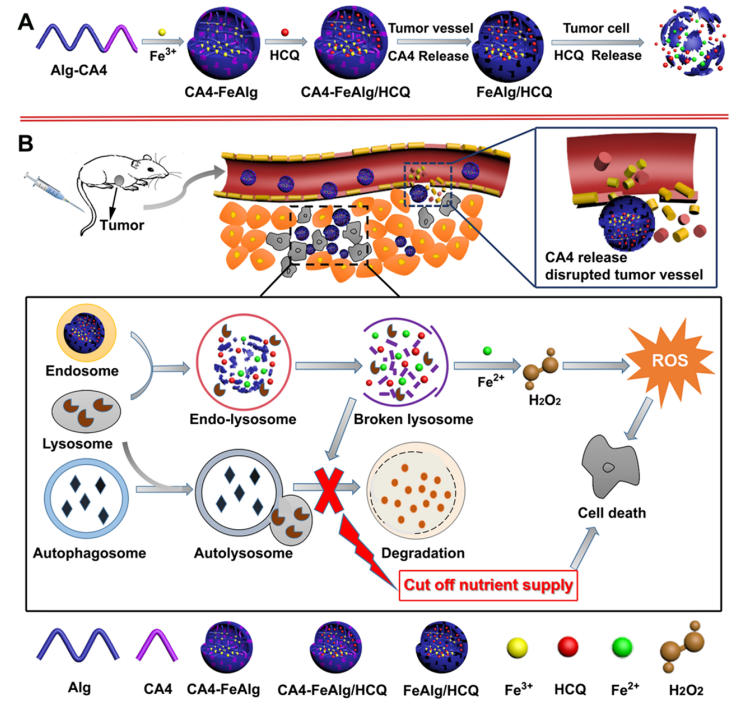



文献解读|定位重塑型纳米凝胶介导共递送抗血管药物和自噬抑制剂,实现对肿瘤的协同治疗
作者:北京索莱宝科技有限公司 2021-01-29T10:07 (访问量:6360)
北京索莱宝科技有限公司 商家主页
地 址: 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号85A三层
联系人: 索莱宝-龚思雨
电 话: 010-50973130
传 真:
Email:3193328036@qq.com
相关咨询
携手同行,共赢未来|索莱宝20周年经销商大会暨品牌发布会圆满落幕! (2024-12-12T00:00 浏览数:3260)
喜报|热烈祝贺北京索莱宝科技有限公司荣获“北京市质量管理工作先进集体” (2024-12-12T00:00 浏览数:3238)
花香蝶自来|Solarbio小分子化合物“优秀员工展”第十五期 (2024-12-12T00:00 浏览数:3153)
自噬体标志物 (2024-12-12T00:00 浏览数:2388)
文献简报|一种用于增强癌症免疫治疗的极简型病原体样糖纳米疫苗 (2024-12-12T00:00 浏览数:3233)
官宣|索莱宝第五届病理杯美图创意大赛结果公布 (2024-12-09T00:00 浏览数:4029)
喜讯|热烈庆贺索莱宝荣获“科学技术协会”授牌 (2024-12-09T00:00 浏览数:5920)
FAQ|Solarbio 同位素标记物 (2024-12-09T00:00 浏览数:5425)
10月文献回顾索莱宝产品护航科研之旅 (2024-12-09T00:00 浏览数:5632)
白细胞介素之抗炎细胞因子 (2024-12-09T00:00 浏览数:5452)
